Sumario
Puesta al día en...
2014, vol. 7, nº 4
Abordaje de la tuberculosis en la edad pediátrica
Autores: Grande Tejada A1, Ruiz-Aragón J2, Rodríguez Vega H3, Alfayate Miguélez S4, Rivero Calle I5
1 Pediatra Atención Primaria. Badajoz. Badajoz (España).
2 Grupo de Investigación Enfermedades Infecciosas Pediátricas. Sevilla. (España).
3 Pediatra Atención Primaria. C. S. Aldaia. Valencia. (España).
4 Murcia (España).
5 Servicio de Pediatría, Hospital Clínico Universitario de Santiago de Compostela. Santiago de Compostela. (España).
1 Pediatra Atención Primaria. Badajoz. Badajoz (España).
2 Grupo de Investigación Enfermedades Infecciosas Pediátricas. Sevilla. (España).
3 Pediatra Atención Primaria. C. S. Aldaia. Valencia. (España).
4 Murcia (España).
5 Servicio de Pediatría, Hospital Clínico Universitario de Santiago de Compostela. Santiago de Compostela. (España).
PUNTOS CLAVE
- En todo niño en contacto con un enfermo con TB, lo más importante es conocer el estadio de TB del niño (exposición, ITBL o enfermedad).
- Ante un niño con infección o enfermedad tuberculosa y sin conocimiento de exposición debemos llevar a cabo una búsqueda activa de una persona cercana, generalmente adulta, con enfermedad bacilífera.
- La prueba de la tuberculina sigue siendo el método más útil para clasificar la TB en sus diferentes situaciones clínicas.
- Disponemos de nuevas herramientas diagnósticas (Interferón-Gamma Release Assay [IGRA]) que complementan a la PT, especialmente en los casos de interferencia con la vacuna bacilo de Calmette y Guérin (BCG) y cuando existe duda diagnóstica.
- En los mayores de tres años vacunados con BCG, con una PT positiva debe obviarse la BCG.
- Los métodos de referencia para el diagnóstico de la TB son el cultivo y la reacción en cadena de la polimerasa (PCR); la dificultad de obtención de muestras condiciona que el diagnóstico de certeza no siempre sea posible en los niños.
- Todos los niños y adolescentes deben recibir profilaxis primaria (postexposición).
- En España, en todo caso de TB en el cual se desconozca la sensibilidad antibiótica de la M. tuberculosis del caso índice se recomienda iniciar tratamiento con cuatro fármacos, ya que el porcentaje de casos de TB resistentes a isoniacida (H) es mayor del 4%.
RESUMEN
La tuberculosis (TB) es una enfermedad infecciosa, causada por bacterias del complejo Mycobaterium tuberculosis, que constituye un problema de salud púbica y continúa siendo uno de los problemas sanitarios más importantes del mundo. La TB en la edad pediátrica presenta peculiaridades clínicas, diagnósticas y terapéuticas, lo cual condiciona la mayor vulnerabilidad de este grupo etario. Es fundamental su estadiaje: exposición, infección tuberculosa latente (ITBL) y enfermedad, para lo cual debemos utilizar correctamente los test clásicos (prueba de la tuberculina [PT) y manejar adecuadamente las nuevas herramientas diagnósticas. Un niño con infección o enfermedad tuberculosa es una señal de alarma que nos obliga a llevar a cabo una búsqueda activa de una persona cercana, generalmente adulta, con enfermedad bacilífera. El diagnóstico de certeza de TB en niños no siempre se consigue, pero existen nuevas posibilidades para la obtención de muestras que pueden aumentar el número de aislamientos de Mycobacterium tuberculosis.
INTRODUCCIÓN
Mycobaterium tuberculosis (M. tuberculosis) es un bacilo ácido-alcohol resistente (BAAR), no esporulado, cuyo aislamiento precisa un periodo de incubación prolongado. M. tuberculosis se transmite exclusivamente de persona a persona a través de la inhalación respiratoria de secreciones con capacidad infectante. Esta enfermedad es de declaración obligatoria individualizada y continúa siendo un importante problema para la salud pública2,5.
Es fundamental conocer las peculiaridades de la TB en la edad pediátrica, ya que esto va a permitir un diagnóstico y tratamiento precoz de los niños. En lo referente al estadiaje, exposición, ITBL y enfermedad (Tabla 1), se pretende poder responder a las preguntas que surgen en la práctica diaria de la interpretación de la prueba de la tuberculina (PT) y describir las nuevas herramientas diagnósticas de TB disponibles, que durante unos meses han sido las únicas disponibles en nuestro país, debido al desabastecimiento de derivado proteico purificado (PPD), restablecido el pasado octubre de 20141-4,6.
Tabla 1. Clasificación y estadios de la tuberculosis. Mostrar/ocultar
Así mismo, se analizarán las indicaciones terapéuticas adecuadas en función de los diferentes estadios clínicos y los efectos adversos que pueden aparecer con los fármacos que reciben los niños, cuya primera asistencia la reciben en los centros de atención primaria.
EPIDEMIOLOGÍA
La TB actualmente es uno de los problemas sanitarios más importantes en el mundo. La TB es considerada por la Organización Mundial de la Salud (OMS) una emergencia global de salud. La OMS comunicó que nueve millones de personas desarrollaron TB en el año 2013, de las cuales 1,5 millones fallecieron, incluyendo 360 000 personas infectadas por el virus de inmunodeficiencia humana (VIH). El total de casos estimados en niños para el año 2013 fue de 550 0007.
En España, en 2012, se notificaron 6046 casos de TB, lo que corresponde a una tasa de incidencia de 13,1/100 000 habitantes, 379 casos en menores de 15 años, lo que corresponde al 6,3% del total de los declarados (tasa de incidencia 5,4/100 000 habitantes)5.
En los últimos años se ha producido un aumento de la incidencia y prevalencia de la TB, debido a que es una enfermedad no controlada en zonas deprimidas, al aumento de la inmigración, a un mayor número de pacientes inmunodeprimidos (VIH, terapias biológicas…) y a un incremento de resistencias a los fármacos tuberculostáticos de primera línea. En cuanto a la repercusión de la inmigración en la TB en edad pediátrica, hay que destacar querecientemente se ha publicado un estudio epidemiológico en EE. UU. que compara el riesgo de niños nacidos en EE. UU. con padres originarios del país con el riesgo de niños nacidos en EE. UU. cuyos padres no son nativos, concluyendo que el riesgo es 32 veces mayor cuando ambos progenitores no son estadounidenses y seis veces mayor en los niños en los que al menosuno de los progenitores es extranjero8.
En España también hay trabajos que muestran la mayor incidencia de TB en niños con familias inmigrantes que en aquellos cuyos progenitores son nativos, y a su vez lo relacionan con un mayor número de casos de resistencia a isoniacida y de multirresistencia9.
CLÍNICA
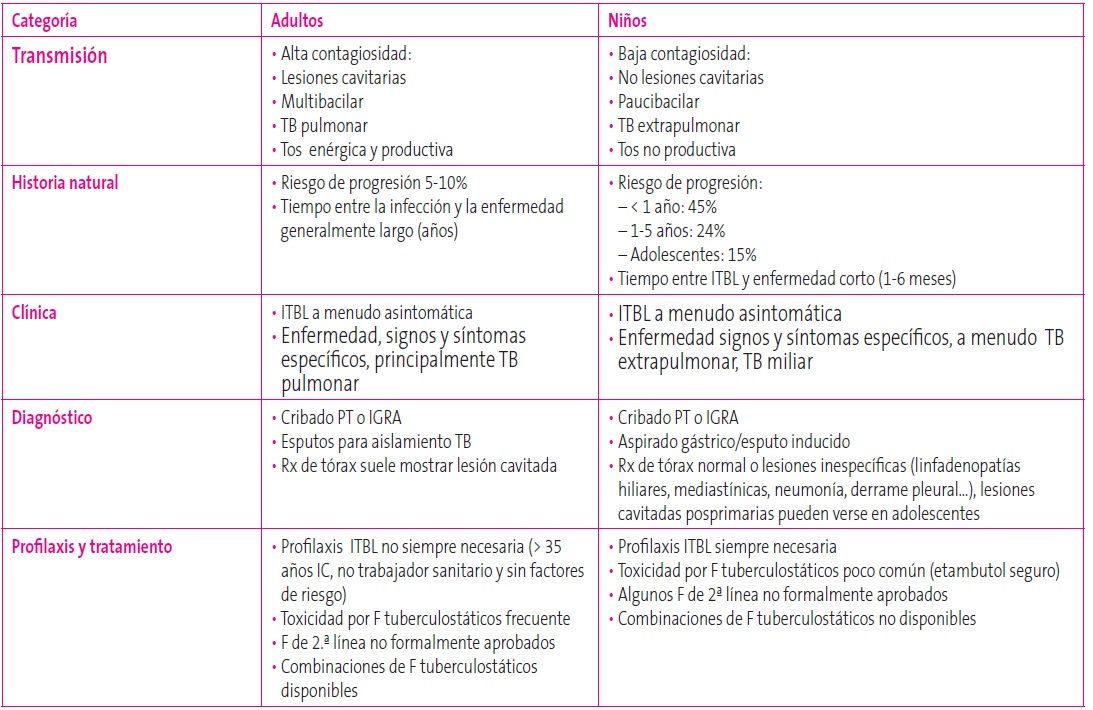
La presentación clínica de la TB es muy variable, desde las formas oligosintomáticas hasta la afectación grave de las formas diseminadas. El riesgo de progresión de infección tuberculosa a enfermedad activa en niños es a menudo breve (de uno a seis meses); a su vez, el riesgo de progresión es mayor en niños, estimándose este en lactantes menores de un año en un 45%, en niños de uno a cinco años en un 24% y en adolescentes en un 15%10.
La afectación pulmonar radiológica en niños es menos específica que en adultos; aunque lo más típico son las adenopatías hiliares y paratraqueales, también puede existir afectación parenquimatosa (neumonía, caverna…). Las calcificaciones y cavernas en niños no son comunes y su aparición indica que la enfermedad ha estado presente durante al menos 6-12 meses2-4,10.
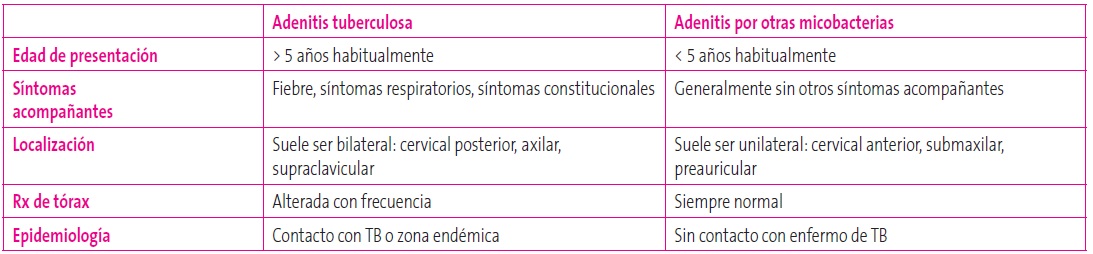
La manifestación extrapulmonar más frecuente en niños es la ganglionar, siendo en estos casos necesario realizar el diagnóstico diferencial con otras micobacterias (Tabla 2). La diseminación hematógena es mucho más frecuente en la edad pediátrica: en torno a un 4% de los niños infectados por debajo de los cinco años desarrollan meningitis tuberculosa o tuberculosis miliar. La manifestación extrapulmonar más severa en los niños, al igual que en adultos, es la afectación del sistema nervioso central (SNC). A menudo los síntomas iniciales de meningitis tuberculosa son inespecíficos: dolor de cabeza, fiebre, vómitos, anorexia, etc. Incluso con tratamiento con antituberculostáticos, la mortalidad por meningitis tuberculosa es alta (20-69%), con secuelas neurológicas permanentes en hasta un 50% de los casos. A nivel del SNC son típicos los tuberculomas en cerebelo10.
Tabla 2. Diagnóstico diferencial entre adenitis tuberculosa y adenitis por otras micobacterias. Mostrar/ocultar
Las lesiones en huesos y articulaciones ocurren en más de un 5% de los casos de TB pediátrica. La osteomielitis, la espondilodiscitis y la artritis son las manifestaciones esqueléticas más frecuentes. Los pacientes inmunocompetentes suelen presentar una lesión única y en inmunodeprimidos son más frecuentes las lesiones múltiples. La afectación vertebral torácica y lumbar (enfermedad de Pott) ocurre en más de un 40% de las formas óseas tuberculosas; su sintomatología inicial puede ser dolor, impotencia funcional o inflamación articular que cursa de forma muy insidiosa y prolongada. También son comunes los quistes óseos y los abscesos musculoesqueléticos (Tabla 3)10.
Tabla 3. Peculiaridades de la tuberculosis en niños. Mostrar/ocultar
DIAGNÓSTICO
Historia clínica
El papel del pediatra de Atención Primaria es fundamental en el diagnóstico de la enfermedad tuberculosa. Una adecuada anamnesis que recoja los antecedentes epidemiológicos es lo que nos va a alertar inicialmente, ya que la sintomatología de la enfermedad TB es muy variable y muy inespecífica en las fases precoces de la enfermedad, tanto es así que la TB es conocida como la “gran simuladora”.
Pruebas complementarias
A pesar de disponer de múltiples herramientas diagnósticas, el diagnóstico de certeza de la TB no siempre es posible en los niños.
Prueba de la tuberculina
La prueba de la tuberculina (PT) sigue siendo el método más útil para clasificar la TB en sus diferentes situaciones clínicas: es accesible, barata y fácil de utilizar en todos los ámbitos de trabajo.
Conservación y técnica de la prueba de la tuberculina
La tuberculina debe conservarse adecuadamente, refrigerada a 4 °C, no congelada y preservada de la luz. La PT consiste en la administración intradérmica de 0,1 ml/2 UI de PPD RT-23 (equivalente a 5 UI de PPD-S); se utiliza una aguja de calibre 272,3,11. La inyección se administra en la cara anterior del antebrazo; la introducción del líquido produce una pápula detectable. Se debe leer a las 72 horas (intervalo permitido entre el segundo y el cuarto día). A veces se produce reacción inmediata en las primeras 24 horas, que luego desaparece (es secundaria a hipersensibilidad inmediata; no se considera positivo). Hay que medir la induración, en milímetros, del diámetro máximo transversal al eje mayor del antebrazo, no el eritema. Si no se produce induración, hay que anotar “0 mm”, no anotar “negativo”.Debe anotarse con fecha y firma en la historia clínica del niño. La induración con vesiculación o necrosis debe catalogarse siempre como positiva2,3,11.
Las vacunas de virus vivos atenuados pueden producir anergia tuberculínica durante las 4-6 semanas siguientes. La PT puede realizarse simultáneamente a la administración de estas vacunas, pero, en caso de administración previa de las mismas, la prueba debe posponerse entre 4 y 6 semanas. La realización de la PT no debe retrasar la administración de estas vacunas, ya que aquella no inmunodeprime1-3,11.
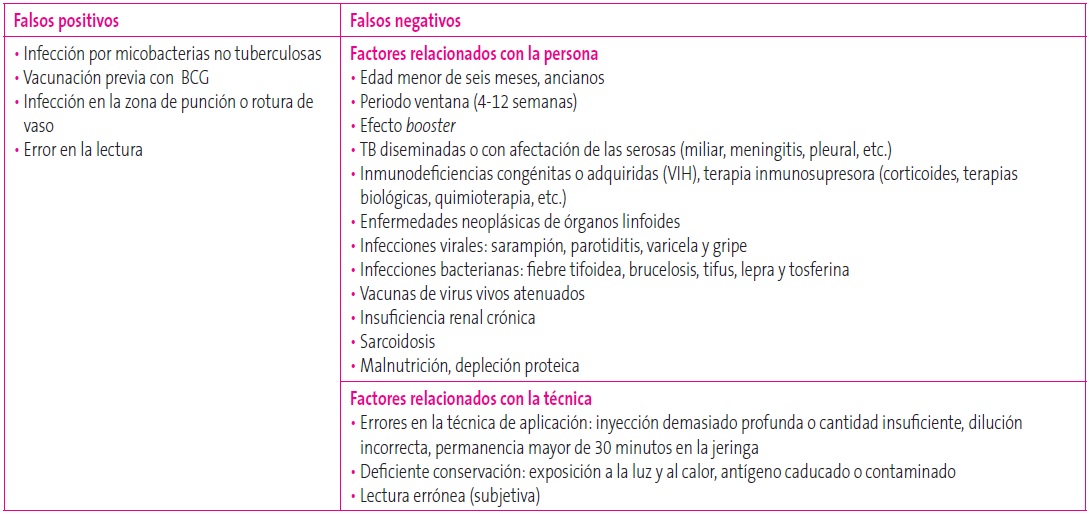
Este test puede presentar falsos negativos y falsos positivos (Tabla 4). Una PT negativa no excluye el diagnóstico de TB, especialmente en niños menores de cinco años, donde la menor sensibilidad de PT y la rápida progresión de la infección TB nos debe hacer adoptar una actitud de alerta, especialmente si existe antecedente epidemiológico (contacto con un enfermo, viaje a un área endémica…)2,3,12.
Tabla 4. Falsos positivos y falsos negativos de la prueba de la tuberculina. Mostrar/ocultar
¿Cuándo debemos realizar la prueba de la tuberculina a los niños que acuden a consulta?
En los casos de contacto con un individuo con sospecha o certeza de TB activa (estudio de los contactos), si existen hallazgos clínicos o radiológicos sugestivos de enfermedad tuberculosa, en población inmigrante o niños adoptados que proceden de países con alta prevalencia, en los niños viajeros procedentes de zonas endémicas y con contacto sustancial con la población nativa (recomendable después de diez semanas tras el regreso) y antes de la administración de inmunosupresores, corticoides o antagonistas del factor de necrosis tumoral alfa1-3,12.
Interpretación de la prueba de la tuberculina
El documento de consenso sobre el diagnóstico de la TB de la Sociedad Española de Infectología Pediátrica (SEIP) concluye que debe considerarse positiva cualquier induración ≥ 10 mm, independientemente de los antecedentes de vacunación con BCG y también los resultados ≥ 5 mm en cualquier paciente en el que se sospeche la enfermedad, contacto íntimo con caso confirmado o sospechoso, niños con inmunodepresión o infección por VIH y en conversiones de la PT2,3,12.
Influencia de la vacunación con BCG en la interpretación de la PT
La recomendación de la vacuna BCG es un tema que sigue generando actualmente controversia. Sin embargo, la OMS recomienda la vacunación tras el nacimiento en países con tasas de prevalencia de TB ≥ 100 casos/100 000 habitantes. A pesar de ello, hay países vecinos al nuestro, como Portugal, que la administran de forma sistemática a toda la población. En España se mantuvo la vacunación con BCG hasta el año 2013 en el País Vasco, y actualmente no se administra en ninguna comunidad autónoma.
En un trabajo recientemente publicado se recomienda que en los niños vacunados con BCG menores de tres años se debe confirmar el resultado positivo de la PT con una técnica basada en el test Interferon-Gamma Release Assay (IGRA). Si la prueba IGRA no está disponible o su resultado es indeterminado, la recomendación sería obviar la BCG. Así mismo, en los niños mayores de tres años directamente se recomienda obviar el antecedente de la vacuna1-3,12,13.
Interferon-Gamma Release Assay (IGRA)
Los test IGRA, al igual que la PT, nos permiten distinguir entre ITBL y enfermedad. Estos test detectan la producción de interferón gamma (IFN-γ) por linfocitos T (LT) sensibilizados frente a M. tuberculosis. Actualmente están comercializadas dos técnicas IGRA: el QuantiFERON-TB-Gold In Tube (QFT-GIT) (Cellestis Limited, Carnegie, Victoria, Australia), basado en la técnica Enzyme-Linked ImmunoSorbent Assay (ELISA) y el T-SPOT.TB (Oxford Immunotec, Abingdon, Reino Unido), basado en una técnica conocida como Enzime-Linked InmunoSorbent SPOT (ELISPOT).
QuantiFERON-TB-Gold In Tube (QFT-GIT)
La técnica QFT-GIT requiere un manejo de las muestras adecuado. El kit comercial consta de tres tubos: uno incluye los tres antígenos Early Secreted Antigenic Target-6 (ESAT-6), Cultured Filtrated Protein-10 CFP-10 y TB 7.7; otro contiene fitohemaglutinina (un mitógeno inespecífico de linfocitos T, control positivo), y el tercero no contiene ningún reactivo (control negativo). Debe recogerse 1 ml de sangre en cada tubo, mezclarse inmediatamente, incubarse a 37 °C durante 18-24 horas y posteriormente centrifugarse. El plasma separado por centrifugación puede conservarse durante varias semanas si fuera necesario, lo que facilitaría la acumulación de muestras para su procesamiento posterior. El último paso consiste en determinar mediante ELISA los niveles de IFN-γ en el plasma extraído de cada uno de los tubos. La interpretación se basa en comparar los niveles de IFN-γ obtenidos en el tubo problema con los obtenidos en los controles positivo y negativo; el resultado será informado como positivo, negativo o indeterminado11.
T-SPOT.TB
Esta técnica precisa un volumen de sangre variable en función de la edad del paciente y de la patología (menores de dos años, 2 ml; de dos a nueve años, 4 ml; adultos, 8 ml; leucopenia, 16 ml). La sangre extraída se procesa para separar las células mononucleares periféricas del resto de componentes sanguíneos y aislarlas a una concentración conocida (250 000 células/ml). Para el ensayo se utiliza una placa con cuatro pocillos: dos contienen los antígenos ESAT 6 y CFP-10 respectivamente y los otros dos pocillos un control negativo y otro positivo. En cada uno de los pocillos se coloca una cantidad idéntica de células mononucleares y se incuba a 37 °C en una atmósfera al 5% de CO2 durante 16-20 horas. El IFN-γ producido por los linfocitos T activados incubados con antígeno es capturado por unos anticuerpos anti-IFN-γ presentes en el fondo de cada pocillo. A continuación se añaden otros anticuerpos, conjugados con fosfatasa alcalina, y dirigidos contra un epítopo diferente del IFN-γ. Por último, se añade un sustrato que cambia de color por acción de la fosfatasa alcalina; de esta manera, se forma una mancha (spot) alrededor de cada una de las células mononucleares productoras de IFN-γ. La interpretación de la prueba se basa en la comparación del número de spots producidos en los pocillos que contienen antígeno con los observados en los controles positivo y negativo. El resultado se informa también como positivo, negativo o indeterminado11,14-16.
Diferencias entre la prueba de la tuberculina y los test IGRA
Los test IGRA utilizan antígenos más específicos de M. tuberculosis que la PT, lo que justifica su mayor utilidad en los casos de niños vacunados con BCG y en los que existe sospecha de infección por micobacterias no tuberculosas (MNT), excepto M. szulgai, M. kansasii, M. marinum y M. flavescens, que también presentan los antígenos utilizados en IGRA. Los IGRA presentan otras ventajas con respecto a la PT, como son su menor tiempo ventana (alrededor de dos semanas), la confidencialidad del niño, la invariabilidad interlectura y la inexistencia de efecto booster11,14-16.
Sensibilidad y especificidad de la prueba de la tuberculina y los test IGRA
Existen múltiples trabajos que muestran datos contradictorios en cuanto a la sensibilidad y la especificidad de estos test diagnósticos. La interpretación de estas pruebas está condicionada por la prevalencia de la ITBL en la región donde se llevan a cabo y por la complejidad del diagnóstico de certeza de enfermedad tuberculosa en niños, por lo que hay que tener precaución en la interpretación de los estudios que incluyen casos probables de TB, por los posibles errores diagnósticos de TB; así lo advierten una revisión sistemática y un metanálisis recientemente publicado14.
Dicho metaanálisis incluye 31 estudios (6183 niños) y concluye que en las áreas de alta prevalencia de TB la sensibilidad del IGRA es similar a la de la PT; en cambio, la especificidad del IGRA es mayor que la de la PT (el 97% frente al84%). En los entornos con baja prevalencia en los estudios que incluyen solamente los casos confirmados microbiológicamente, las cifras de sensibilidad para PT, QFN-G-IT y T-SPOT.TB son, respectivamente, del 74% (IC 95: 68 a 80%), del 66% (IC 95: 55 a 76%) y del 80% (IC 95: 59 a 90%), en cuanto a especificidad e incluyendo todos los casos, la PT muestra un 92% (IC 95: 89 a 93%), QFN-G-IT 97% (IC 95: 96 a 98%) y el T-SPOT.TB un 98% (IC 95: 96 a 99%)14.
Estrategias de uso de la prueba de la tuberculina, el test IGRA o ambos
Se proponen tres estrategias diferentes: uso de una prueba única, PT o IGRA, o utilizar la PT y seguidamente un IGRA en dos pasos escalonados (especialmente útil en los estudios de contactos y los vacunados con BCG) y por último la realización conjunta de PT e IGRA (estrategia que puede aumentar la sensibilidad diagnóstica hasta un 90%)1,11,14,16.
En niños inmunodeprimidos, especialmente en linfopénicos, y en niños de cortas edades, el T-SPOT.TB podría tener cierta superioridad frente al QFT-GIT11,14.
La mayoría de las guías recomiendan la realización de la PT de elección en menores de cinco años, mientras que en mayores de cinco años, vacunados de BCG y con probabilidad de no acudir a la lectura de la PT, las guías suelen recomendar la realización de un IGRA de entrada. Sin embargo, la OMS sigue recomendando la PT, y no recomienda sustituirla por IGRA. La SEIP recomienda la realización de IGRA como prueba complementaria para incrementar la especificidad en los niños vacunados con BCG, en los casos de sospecha clínica de infección por MNT y en el estudio de los contactos en función del riesgo de ITLB y de inmunosupresión11,14.
Diagnóstico microbiológico
Todas las guías diagnósticas coinciden en considerar que la prueba de referencia para la confirmación del diagnóstico de TB es el aislamiento de M. tuberculosis o la reacción en cadena de la polimerasa (PCR)1-3.
Las muestras obtenidas pueden ser esputo espontáneo o inducido, lavado gástrico (LG), líquido cefalorraquídeo (LCR), líquido sinovial, biopsia… en función de la afectación clínica.
La localización más frecuente de la enfermedad tuberculosa en niños es la pulmonar, sin embargo, el aislamiento del bacilo en muestras biológicas ocurre en menos del 50% de los casos1.
El crecimiento de M. tuberculosis en los medios de cultivo no solo confirma el diagnóstico de TB, además permite el genotipado y la determinación de susceptibilidad a antibióticos de la M. tuberculosis1-3.
Los medios de cultivo para M. tuberculosis pueden ser sólidos (tipo Lowestein, entre cuatro y seis semanas) o líquidos (tipo Middlebrook 15 días-1 mes).
Se dispone de técnicas de biología molecular para identificar micobacterias y para determinar resistencias a fármacos tuberculostáticos, el resultado se obtiene de forma rápidas (horas), pero son costosas y sólo disponibles en algunos laboratorios. Todas las guías de manejo de TB coinciden en que la PCR no puede reemplazar al cultivo1-3.
Un obstáculo para la confirmación diagnóstica de la TB pulmonar es la obtención de muestras en lactantes y niños pequeños, que habitualmente es difícil; una forma clásica para conseguirlas es la realización del aspirado gástrico durante tres días consecutivos, en ayunas, lo que precisa la hospitalización del paciente. Existen múltiples publicaciones que proponen una alternativa o determinación complementaria al tradicional LG: la realización del esputo inducido (EI).17
Jugos gástricos
Clásicamente, en los niños que no consiguen expectorar de forma espontánea, la alternativa ha sido el LG. La recogida de jugos gástricos se debe realizar por la mañana, después de ayuno nocturno. Se coloca una sonda nasogástrica a través de la cual se administran 20 ml de suero salino fisiológico, durante tres minutos. Posteriormente se realiza el aspirado, repitiendo el procedimiento con 5-10 ml de suero salino fisiológico hasta conseguir un mínimo de 20 ml de aspirado en total17.
Esputo inducido
La obtención del EI es un procedimiento que permite el estudio en pacientes que no son capaces de expectorar o en quienes no producen esputo suficiente. Se puede realizar a cualquier hora del día, previo ayuno de dos o tres horas, y no la requiere hospitalización del paciente. La técnica de recogida consiste, en primer lugar, en la administración de 0,15 mg/kg (máximo 5 mg) de salbutamol nebulizado con el objetivo de prevenir un posible broncoespasmo por el uso del suero hipertónico. En segundo lugar se nebulizan 5 ml de suero salino al 5% con un flujo de 5 l por minuto durante 15 minutos. Posteriormente se realiza una percusión del tórax por delante y por detrás; después de este procedimiento, si el niño no expectora espontáneamente, se obtendrá el esputo a través de la nasofaringe con un aspirador con sonda estéril. Durante el procedimiento se debe realizar el seguimiento de la saturación de oxígeno y se deberán llevar a cabo las medidas de aislamiento adecuadas: una habitación con presión negativa (o en su defecto, una habitación con adecuada ventilación) y que el personal utilice mascarillas con filtros High Efficiency Particle Arresting (HEPA)17,18.
Varios estudios han comparado el rendimiento de EI frente al LG en niños.Gran parte de estos trabajos son realizados en países en vías de desarrollo, la mayoría de ellos en el ámbito hospitalario y algunos en poblaciones con una alta prevalencia de infección por VIH17.
En el estudio de Ruiz- Jiménez et al., realizado en el hospital de Getafe, que incluye 22 niños hospitalizados con sospecha clínica o radiológica de TB pulmonar y sin evidencia de inmunosupresión, se pretendía evaluar la seguridad y rentabilidad diagnóstica del EI combinado con el LG para el diagnóstico de la TB pulmonar. Para ello se realizaron EI y LG durante tres días consecutivos siguiendo un protocolo estandarizado, describiendo de forma clara y concisa la obtención del EI. Los autores concluyeron que el EI es una técnica segura y que debería ser considerada como una técnica complementaria al LG, al menos en los países en vías de desarrollo donde existen cepas con resistencia a fármacos tuberculostáticos elevadas.Los autores manifiestan que son necesarios futuros trabajos que aclaren si el esputo inducido podría convertirse en una técnica complementaria al jugo gástrico, con el fin de aumentar la rentabilidad diagnóstica17,18.
Estudios radiológicos
Se realizarán en función de la clínica: radiografía (Rx) de tórax si existe sospecha de TB pulmonar, tomografía computarizada (TC) craneal con contraste o resonancia magnética nuclear en caso de TB del SNC, ósea o abdominal. En cuanto a las indicaciones de TC torácica en TB pulmonar, se recurrirá a ella cuando la radiología sea dudosa o en caso de Rx de tórax normal en niños con alto riesgo de progresión a enfermedad1-3.
PROFILAXIS
Profilaxis primaria
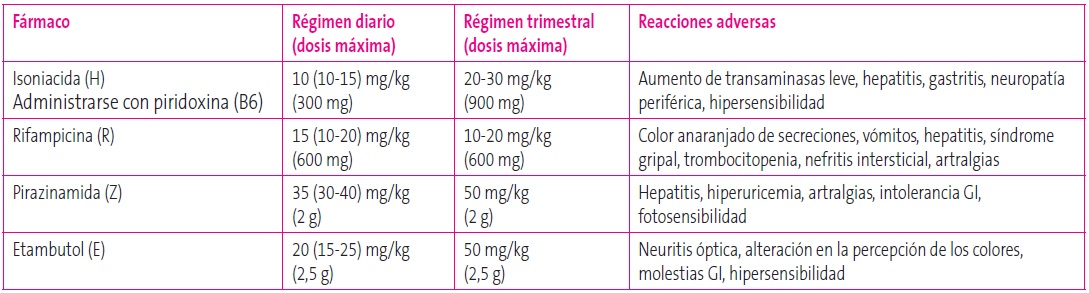
Se recomienda en todos los niños y adolescentes expuestos sin evidencia de infección 10 mg/kg/día (máximo 300 mg/día) de isoniacida (H) durante dos meses (Tabla 1). En caso de resistencia a la H se puede utilizar rifampicina (R) a dosis de 10 mg/kg/día (máximo 600 mg/día) igualmente durante dos meses. En caso de resistencia a la H y a la R, no hay datos en niños, pero se recomienda una vigilancia estrecha y prolongada. Tras estos dos meses, se repetirá PT/IGRA; en caso de resultar negativos se suspenderá la profilaxis y si resultan positivos habrá que realizar una Rx de tórax y la evaluación general del niño. Si se descarta la enfermedad se completará profilaxis secundaria1-4,15.
Profilaxis secundaria
Las guías de práctica clínica recomiendan la profilaxis secundaria a todos los niños con historia de exposición a la TB, PT o IGRA positivos y sin evidencia de TB activa1-4,15. Existen diferentes pautas: la clásica es la realizada con 10 mg/kg/día (máximo 300 mg/día) de H durante nueve meses, según recomienda la SEIP. Otras pautas alternativas son el uso de R a dosis de 10 mg/kg/día (máximo 600 mg/día) durante seis meses (en adolescentes puede administrarse durante cuatro meses) o la utilización conjunta de R y H durante tres meses, recomendada solo por algunas guías internacionales1-4,10,15.
Un régimen alternativo es la administración de forma intermitente, en los casos en que sea difícil asegurar el cumplimiento diario, de 15 mg/kg/día de H, tres días por semana, durante nueve meses (posible 6 meses y en caso de inmunodeprimidos 12 meses). Una pauta de 12 dosis de rifapentina e isoniazida administradas semanalmente ha mostrado ser eficaz en adultos, pero no hay datos disponibles en niños menores de 12 años; esta pauta abreviada tampoco ha sido bien estudiadas en paciente infectados por VIH1-4,15.
Los efectos adversos de la isoniacida más frecuentes son generalmente leves, como nauseas, cefalea, exantema, hepatitis o neuropatía periférica. La complicación más grave asociada a la H es la hepatitis, pero en la edad infantil es infrecuente, por lo que no está indicada la realización sistemática de controles analíticos, solo se realizarán determinaciones de laboratorio en caso de sospecha clínica de hepatotoxicidad. En caso de un aumento de transaminasas leve, se debe disminuir la dosis de H a 5 mg/kg/día o instaurar la pauta intermitente con H. Debe suspenderse la H en caso de niños sintomáticos con elevación de transaminasas tres veces por encima de lo normal o en asintomáticos con niveles cinco veces por encima de lo normal2,3.
TRATAMIENTO DE LA TUBERCULOSIS
Desde la emergencia de los primeros casos de resistencia a fármacos antituberculosos en los años 90, es recomendable el uso inicial de cuatro fármacos durante la fase de inducción (los primeros dos meses) en las regiones donde la resistencia a isoniacida es mayor del 4%, como es el caso de España, hasta conocer la sensibilidad de la cepa de M. tuberculosis del caso índice o del propio enfermo; por esto es fundamental realizar estudio de resistencias en todos los aislamientos de M. tuberculosis.
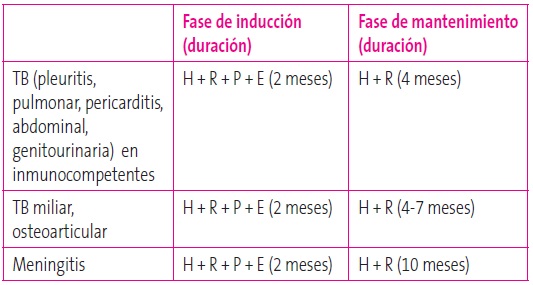
En cuanto a la duración del tratamiento con fármacos antituberculosos, consta de una primera fase de inducción de dos meses (salvo TB multirresistente) y la fase de mantenimiento es variable en función de la clínica de la enfermedad tuberculosa y del estado inmunológico del paciente (Tabla 5).
Tabla 5. Tratamiento de la enfermedad tuberculosa. Mostrar/ocultar
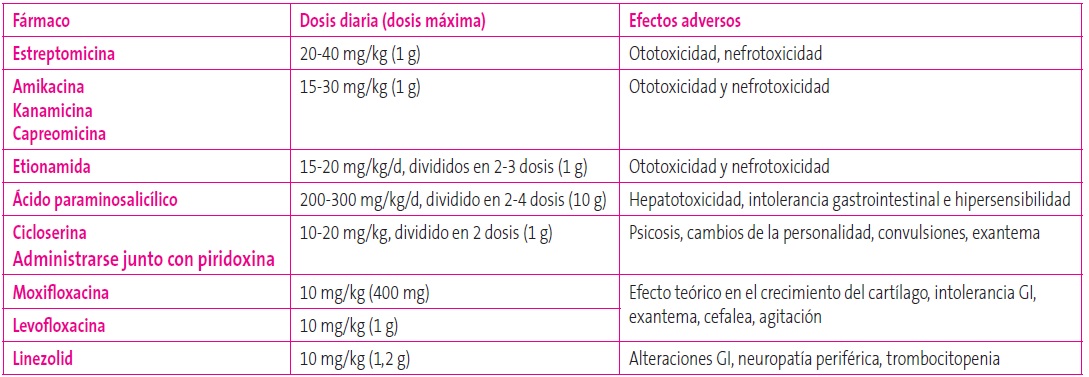
Las dosis de fármacos para TB fueron modificadas por la OMS en 2009 y por la SEIP en 2012, puesto que en varios estudios de farmacocinética se alcanzaban niveles de fármacos más bajos en sangre en niños que en los adolescentes y adultos (Tablas 6 y 7)19.
Tabla 6. Fármacos antituberculosos de primera línea. Mostrar/ocultar
Tabla 7. Fármacos antituberculosos de segunda línea. Mostrar/ocultar
Actualmente la pauta de elección es diaria, aunque en casos puntuales se puede utilizar pauta intermitente (tres veces a la semana). En la TB multirresistente y en niños inmunodeprimidos no se recomienda pautas intermitentes.
El uso de corticoides está indicado en caso de TB pulmonar complicada (atelectasia o TB endobronquial), TB miliar y TB osteoarticular y abdominal en la que haya compresión medular.
CRITERIOS DE HOSPITALIZACIÓN
En los niños con enfermedad TB es recomendable el ingreso hospitalario para comprobar que la recogida de las muestras es adecuada en búsqueda de M. tuberculosis; a su vez, la hospitalización permite vigilar la tolerancia al tratamiento y evaluar la adherencia posterior. Otras indicaciones de hospitalización son las complicaciones de la TB (pulmonares complicadas, formas diseminadas, TB extrapulmonar, excepto ganglionar), TB en inmunodeprimidos, sospecha de resistencias, fracaso del tratamiento previo (tras al menos dos meses) y la sospecha o riesgo de incumplimiento terapéutico, al tratarse un de un problema de salud pública además de individual.

BIBLIOGRAFÍA
- Berti E, Gali L, Venturini E, De Martini M, Chiappini E. Tuberculosis in chilhood: a systematic review of national and international guidelines. BMC Infect Dis. 2014;14:S3.
- Mellado MJ, Méndez Echevarría A, García Miguel MJ. Tuberculosis. Infectología pediátrica básica. Manejo práctico. México: Editorial Panamericana; 2012. p. 291-301.
- Moreno Pérez D, Andrés Martín A, Altet Gómez N, Baquero-Artigao F, Escribano Montaner A, Gómez-Pastrana Durán D, et al. Diagnóstico de la tuberculosis en la edad pediátrica. An Pediatr (Barc). 2010;72:283.e1-283.e14.
- Pérez-Vélez CM, Marais BJ. Tuberculosis in children. N Engl J Med. 2012;367:348-61.
- Informe epidemiológico sobre la situación de la tuberculosis en España. Año 2012. (Datos a 12 de septiembre de 2013). En: Instituto de Salud Carlos III [en línea] [consultado el 12/12/2014]. Disponible en: http://www.isciii.es/ISCIII/es/contenidos/fd-servicios-cientifico-tecnicos/fd-vigilancias-alertas/fd-enfermedades/TB_Informe_2012_CNE_8abril2014.pdf
- Nota de actualización del Comité de Medicamentos de la AEP sobre la situación de la tuberculina en España. En: Asociación Española de Pediatría [en línea] [consultado el 12/12/2014]. Disponible en: http://www.aeped.es/comite-medicamentos/noticias/nota-actualizacion-comite-medicamentos-aep-sobre-situacion-tuberculina-en-espana
- Global tuberculosis report 2014. En: World Health Organization [en línea] [consultado 12/12/2014]. Disponible en: http://www.who.int/tb/publications/global_report/en/
- Pang J, Teeter LD, Dolly J, Katz DJ, Davidow AL, Miranda W, et al. Epidemiology of tuberculosis in young children in the United States. Pediatrics. 2014 Mar;133:e494-504.
- Santiago B, Baquero-Artigao F, Mejías A, Blázquez D, Jiménez MS, Mellado-Peña MJ, et al. Pediatric drug-resistant tuberculosis in Madrid family matters. Pediatr Infect Dis J. 2014;33:345-50.
- Piccini P, Chiappini E, Tortoli E, De Martino M, Galli L. Clinical peculiarities of tuberculosis. BMC Infect Dis. 2014;14:S4.
- Rodríguez Vega H.D, Alfayate Miguelez S, Grupo de Patología Infecciosa de la Asociación Española de Pediatría en Atención Primaria. Diagnóstico de la Tuberculosis en Pediatría. En: AEPAP [en línea] [consultado el 12/12/2014]. Disponible en: http://goo.gl/wvUc0F
- Gargallo E. Novedades en el diagnóstico in vitro de la tuberculosis. An Pediatr Contin. 2010;8:201-7.
- Piñeiro Pérez R, Cilleruelo Ortega MJ, Mellado Peña MJ. BCG en la interpretación de la prueba de tuberculina. An Pediatr Contin. 2014;12:74-7.
- Sollai S, Galli L Martino M, Chiappini E. Systematic review and meta-analysis on the utility of Interferon-gamma release assays for the diagnosis of Mycobacterium tuberculosis infectionin children: a 2013 update. BMC Infect Dis. 2014;14:S6.
- Cruz AT, Starke JR, Lobato MN. Old and new approaches to diagnosing and treating latent tuberculosis in children in low-incidence countries. Curr Opin Pediatr. 2014;26:106-13.
- Bamford AR, Crook AM, Clark JE, Nademi Z, Dixon G, Paton JY, et al. Comparison of interferon-gamma release assays and tuberculin skin test in predicting active tuberculosis (TB) in children in the UK: a paediatric TB network study. Arch Dis Child. 2010;95:180-6.
- Grande Tejada AM, Grupo de Patología Infecciosa de la Asociación Española de Pediatría de Atención Primaria. Esputo inducido versus lavado gástrico en el diagnóstico de TBC pulmonar. En: AEPAP [en línea] [consultado el 12/12/2014]. Disponible en: https://www.aepap.org/sites/default/files/esputo_inducido_versus_lavado.pdf
- Ruiz-Jiménez M, Guillén Martín S, Prieto Tato LM, Cacho Calvo JB, Álvarez García A, Soto Sánchez B, et al. Induced sputum versus gastric lavage for the diagnosis of pulmonary tuberculosis in children. BMC Infect Dis. 2013;13:222.
- Mellado Peña MJ, Piñeiro Pérez R, Medina Claros A, Bravo Acuña J, Cabrera García L, Martínez Fernández-Llamazares, et al. Documento técnico: informe y recomendaciones del comité de medicamentos de la AEP sobre la modificación de las dosis de fármacos antituberculosos de primera línea en niños. En: AEPED [en línea] [consultado el 12/12/2014]. Disponible en: http://www.aeped.es/comite-medicamentos/noticias/informe-y-recomendaciones-comite-medicamentos-
LECTURAS RECOMENDADAs
-
Berti E, Gali L, Venturini E, De Martini M, Chiappini E. Tuberculosis in chilhood: a systematic review of national and international guidelines. BMC Infect Dis. 2014;14:S3.
Excelente y actualizada revisión de las guías diagnósticas y terapeúticas de tuberculosis de la Organización Mundial de la Salud (OMS), CDC (Center for Disease Control and Prevention), Sociedad Española de Infectología Pediátrica (SEIP), Academia Americana de Pediatría (AAP), etc. Incluye tablas comparativas de gran utilidad.
-
Moreno Pérez D, Andrés Martín A, Altet Gómez N, Baquero-Artigao F, Escribano Montaner A, Gómez-Pastrana Durán D, et al. Diagnóstico de la tuberculosis en la edad pediátrica. An Pediatr (Barc). 2010;72:283.e1-283.e14.
Documento exhaustivo en cuanto al diagnóstico de tuberculosis por parte de la Sociedad Española de Infectología Pediátrica y Sociedad Española de Neumología Pediátrica, su lectura es imprescindible.
-
Pérez-Vélez CM, Marais BJ. Tuberculosis in children. N Engl J Med. 2012;367:348-61.
En esta publicación se revisa de forma precisa la historia natural, clínica, diagnóstico, clasificación de la tuberculosis, así como su prevención y control.
-
Sollai S, Galli L Martino M, Chiappini E. Systematic review and meta-analysis on the utility of Interferon-gamma release assays for the diagnosis of Mycobacterium tuberculosis infectionin children: a 2013 update. BMC Infect Dis. 2014;14:S6.
Revisión y metanálisis reciente sobre las nuevas herramientas diagnósticas para la tuberculosis, IGRA (QFT-GIT y T-SPOT. TB.).