Sumario
Más allá de la clínica
2015, vol. 8, nº 1
Probióticos y prebióticos en Pediatría (2.ª parte)
Autores: Panisello Royo JM1
1 Pediatra Atención Primaria. Servicio de Medicina Interna del Policlínico San Carlos. Barcelona. Directora General de la Fundación para el Fomento de la Salud. Barcelona (España).
1 Pediatra Atención Primaria. Servicio de Medicina Interna del Policlínico San Carlos. Barcelona. Directora General de la Fundación para el Fomento de la Salud. Barcelona (España).
RESUMEN
La existencia de una relación entre la microbiota intestinal y los trastornos metabólicos y sus bases fisiopatológicas sugiere que la manipulación intencionada de la microbiota puede constituir una herramienta más para reducir enfermedades cuya prevalencia va en aumento, como las cardiometabólicas, entre ellas la obesidad. Por otra parte, el rol fundamental que la microbiota ejerce en la maduración de nuestro sistema sistema inmune debe ser tenido en cuenta a la hora de abordar el manejo de las enfermedades de etiología alérgica.
En cuanto a la obesidad, estudios observacionales en humanos establecen asociaciones entre determinados componentes de la microbiota intestinal, la obesidad, y la regulación del peso corporal, así como entre la microbiota intestinal y la diabetes mellitus tipo 2. Un número importante de estos estudios indican que el fenotipo delgado y la reducción efectiva del peso corporal tras una restricción calórica, están relacionados con aumentos del filo Bacteroidetes o de los subgrupos del género Bacteroides, acompañados en algunos casos de reducciones del filo Firmicutes o sus subgrupos (Clostridium). No obstante, la existencia de resultados contradictorios no nos permite aseverar con seguridad qué grupos bacterianos son relevantes en la obesidad.
A pesar de algunos estudios esperanzadores, carecemos de suficientes análisis de intervención en humanos que incluyan determinación del enterotipo, cepas bacterianas específicas y un adecuado diseño experimental. Solo resultados significativos y reproducibles en estudios de alta calidad metodológica que contemplen estas características en la obesidad y en sus trastornos relacionados, nos permitirá avanzar.
En cuanto a las enfermedades de etiología alérgica, en una sociedad en la que la exposición a los gérmenes ha disminuido grandemente, la importancia que la exposición a la microflora tiene sobre la proporción linfocitos T-helper 1 y 2 aumenta. Y aunque es mucho el camino que nos queda por recorrer, sabemos que, si bien la administración de probióticos en edades tempranas de la vida es efectiva a la hora de disminuir los niveles de inmunoglobulina E (IgE) y el riesgo de atopia en niños pequeños, no sucede así con el asma.
ENFERMEDADES DE BASE ALÉRGICA
La prevalencia mundial de trastornos de etiología alérgica, tales como la dermatitis atópica, la rinoconjuntivitis alérgica y el asma, es elevada, habiéndose incrementado de forma significativa en las pasadas décadas1. De hecho, se estima que un 20% de la población sufre alguna forma de enfermedad alérgica2. La “hipótesis higiénica”, formulada como una posible explicación para el aumento de la prevalencia de las enfermedades alérgicas, sugiere que el aumento en las condiciones de limpieza, la disminución en el tamaño de las familias, junto a la disminución de las infecciones en los niños, han comportado una menor exposición de estos a los microbios, los cuales juegan un rol fundamental en la maduración del sistema inmune del huésped durante los primeros años de vida3.
La microbiota intestinal puede contribuir a la patogénesis de los trastornos alérgicos debido al importante efecto que ejerce sobre la inmunidad en las mucosas. De esta manera, sabemos que la exposición a la flora normal en los primeros años de vida comporta cambios en el balance entre los linfocitos T-helper 1 (Th1) y los linfocitos T-helper 2 (Th2), favoreciendo un aumento de los primeros4. En los trastornos atópicos, por el contrario, se da una mayor respuesta mediada por Th25 ; en los trastornos alérgicos se daría una respuesta anormalmente elevada por parte del sistema inmune aún en desarrollo, en ausencia de una flora microbiana intestinal normal6,7. De hecho se produciría un disbalance entre los linfocitos T-helper 1 y 2 disminuyendo el ratio Th1/Th2 por el aumento de estos últimos. Por otra parte se produciría también un aumento de las citocinas secretadas por los Th2, tales como las interleucinas (IL) IL-3, Il-4, Il-5 así como un aumento en la producción de las IgE8.
Dermatitis atópica
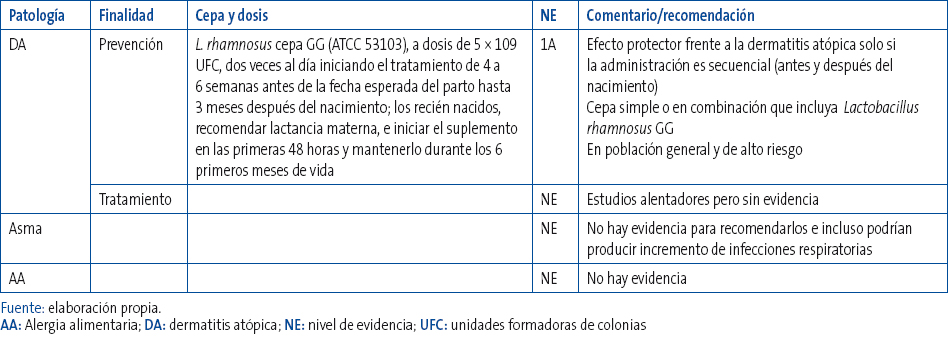
La comercialización de probióticos orientados a individuos que presentan enfermedades atópicas o riesgo de presentarlas va en aumento. Su uso para la prevención de la atopia se inició tras la publicación de dos estudio aleatorizados controlados (EAC) escandinavos en revistas de alto impacto1,2,3. En el primero, Kalliomaki et al., en 2001, demostraron que la administración de Lactobacillus rhamnosus cepa GG American Type Culture Collection 53103 (ATCC 53103) reducía prácticamente a la mitad (RR=0,51; IC 95%: 0,32 a 0,84) la incidencia de eccema atópico en niños en riesgo de padecerlo durante los dos primeros años de vida; este efecto se extendía hasta los cuatro y siete años sin evidenciarse diferencias en cuanto a la presentación de rinitis o asma. En el segundo, Kukkonen et al., en un gran estudio (n=925), llegaron a semejantes conclusiones utilizando esta vez una mezcla de cuatro probióticos, que incluía también Lactobacillus rhamnosus cepa GG (ATC 53103) y que se administraba prenatalmente a la madre y posnatalmente al recién nacido asociando en este caso prebióticos (6 g diarios de galactooligosacáridos) durante los 6 primeros meses de vida). Poco después de que Kalliomaki publicara sus resultados de seguimiento a los siete años, aparece el estudio del grupo australiano de Taylor4, que no solo no encuentra diferencias en la prevalencia de dermatitis atópica (DA), sino que observa un aumento de la sensibilización del grupo de niños tratados con probióticos. No obstante, en este estudio se había utilizado una cepa distinta de lactobacillus (3 × 109 Lactobacillus acidophilus LAVRI-AI en preparación magistral por la farmacia hospitalaria, una vez al día desde el nacimiento hasta los seis meses de edad) y recibían el tratamiento solo los recién nacidos (no la madre). Estos resultados discordantes y la controversia que generaron llevó al grupo de Kopp et al. a plantear nuevamente un estudio aleatorizado, doble ciego y con placebo control en 105 mujeres embarazadas con antecedentes de atopia5. Se utilizó la misma cepa que en el estudio de Kalliomaki (Lactobacillus rhamnosus cepa GG [ATCC 53103]), a dosis de 5 × 109 unidades formadoras de colonias (UFC) dos veces al día frente a placebo iniciando el tratamiento de cuatro a seis semanas antes de la fecha esperada del parto hasta tres meses después del nacimiento; los recién nacidos, todos alimentados a pecho, iniciaban el suplemento en las primeras 48 horas y se les mantenía durante los seis primeros meses de vida. Las conclusiones fueron que la suplementación con Lactobacillus rhamnosus GG no reducía ni la prevalencia ni la gravedad de la dermatitis atópica ni los episodios de infecciones respiratorias altas, ni comportaba modificaciones en los niveles de IgE o en los resultados de sensibilización a antígenos inhalados, aunque sí se asociaba a un aumento en los episodios de bronquitis broncoobstructiva (26%, n=13, frente a 9,1%, n=4, p=0,003). En consecuencia, postularon que el suplemento con Lactobacillus rhamnosus GG no podía ser recomendado de forma generalizada en la prevención primaria.
Paralelamente, otros estudios como el de Abrahamsson et al.6, si bien utilizaron otras cepas, en concreto L. reuteri, tampoco encontraron diferencias en el efecto preventivo sobre eccemas infantiles, aunque sí sobre eccemas asociados a IgE.
En el año 2012 aparece por vez primera un metaanálisis. De hecho, ese año se publicaron dos metaanálisisdistintosque llegan a conclusiones parecidas, pero no iguales: el de Doegue7, que incluyó 16 estudios, confirma que la administración de Lactobacilli durante el embarazo previene el eccema atópico en los niños de dos a siete años, pero no encuentra este efecto protector cuando la preparación administrada de probióticos es una mezcla de cepas. El de Pelucchi8, que incluye 14 estudios aleatorizados, confirma que se observa un papel moderado de los probióticos en la prevención de la dermatitis atópica y de los niveles de la IgE asociados con la dermatitis atópica en los lactantes, pero no entra a analizar ni el tipo de probióticos administrados ni el tiempo de administración, así como tampoco en qué población se daría el beneficio, si en la de elevado riesgo y/o en la población general.
En 2014 se han publicado dos metaanálisis distintos: El primero, publicado en marzo por Panduru et al.9 (análisis de estudios desde 1995 hasta diciembre del 2013), incluyó en el metaanálisis un total de 26 publicaciones que correspondían a 16 poblaciones estudiadas, con un total de 3495 sujetos. En este metaanálisis, a diferencia de los previos que valoraban el uso de los probióticos en la prevención de la dermatitis atópica, también se incluyó un metaanálisis de distintos subgrupos dirigidos a evaluar el tipo de probiótico así como el periodo de administración. Las conclusiones fueron:
- La administración de probióticos ejerce un efecto protector frente a la dermatitis atópica (R=0,56, IC=0,52-0,6; p=0,0001).
- El efecto protector se produce solamente cuando la administración se da secuencialmente antes y después del nacimiento.
- No se encuentra efecto protector si los probióticos se dan solo posnatalmente.
- La eficacia es independiente del uso de la cepa simple Lactobacillus rhamnosus GG o de una combinación de distintas cepas que la incluyan.
- La protección se da en la prevención primaria de la DA tanto en población de alto riesgo como en población general.
En septiembre del mismo año, Elazabet al.10 publican en la revista Pediatrics un metaanálisisde todos los estudios que valoran atopia y asma. En relación con la DA, se incluyeron 21 estudios correspondientes a 14 cohortes, con un total de 2797 sujetos. Los resultados evidencian la disminución del riesgo de presentar sensibilización atópica, medida por positividad en el niveles de IgE especifica (RR: 0,90, IC 95%: 0,80 a 1,00; p=0,060). Confirman también que la reducción es significativa cuando se administran prenatal y posnatalmente (RR: 0,88; IC 95%: 0,78 a 0,99; p= 0,035), pero no cuando se dan solo posnatalmente (p=0,825). El metaanálisismultivariado mostró que la administración de Lactobacillus acidophilus se asoció con un aumento de riesgo de sufrir sensibilización atópica (p=0,02).
Estos resultados son coherentes con la hipótesis higiénica que propone que una carencia relativa de exposición a los microbios durante la infancia puede resultar en un disbalance entre los distintos tipos de respuestas inmunes, de manera que favorecería el desarrollo de respuestas alérgicas mediadas por IgE. Dado que los niños con atopia, comparados con los que no presentan esta condición, parecen tener diferencias en el microbioma intestinal11, diferencias que preceden a la aparición del eccema, la administración de probióticos tempranamente en la vida podría ayudar a promover una microflora intestinal más saludable, la cual sabemos que tiene un papel imprescindible en la maduración del sistema inmune.
Asma
Durante la ultima mitad del siglo pasado hemos asistido a un incremento franco de la prevalencia (cifrado en un 50% por cada década) del asma, sobre todo en población infantojuvenil, de forma que ha pasado a ser la enfermedad crónica más prevalente en la infancia. Uno de cada cinco niños en Europa y EE. UU. la presenta, siendo la mayor causa de absentismo escolar. Una de las hipótesis para explicar este incremento es la que lo relaciona con cambios en la microflora.
Muchos de los factores de riesgo del asma son factores que contribuyen a la alteración de la flora intestinal (como nacimiento por cesárea, ausencia de lactancia materna y uso de antibióticos). Además son numerosos los estudios que muestran que la alteración de la flora intestinal precede al desarrollo de la dermatitis atópica12,13, a la que hemos dado en considerar como el primer paso de la llamada “marcha atópica”, que suele seguirse de rinitis y asma12. Es por ello que han sido múltiples los estudios propuestos para conocer el papel que podrían desempeñar los probióticos en el tratamiento y prevención del asma. A la revisión de la Cochrane del 200714 (tres estudios clínicos de buena calidad metodológica que enrolaron un total de 617 niños) sobre el uso de suplementos de probióticos en edades tempranas de la vida para la prevención de las enfermedades alérgicas (que no encontró beneficios en el asma) hay que sumar dos metaanálisis publicados el pasado 2013: el primero por Elazab et al.10 en Pediatrics y el segundo por Azad et al.15 en el British Medical Journal. El primero de ellos identificó 1081 artículos. De estos incluyó en el metaanálisispracticado 25 estudios correspondientes a 20 cohortes, con un total de 4031 participantes. Las conclusiones fueron que, si bien la administración de probióticos en edades tempranas de la vida es efectiva a la hora de disminuir los niveles de IgE y el riesgo de atopia en niños pequeños, no sucede así con el asma.
Por todo ello concluimos que no hay evidencias para recomendar la administración prenatal y/o posnatal de probióticos para la prevención primaria del asma (Tabla 1 ).
Tabla 1. Tabla resumen de las indicaciones basadas en la evidencia referentes al uso de probióticos y prebióticos en enfermedades alérgicas en Pediatria. Mostrar/ocultar
Esofagitis eosinofílica
Esta entidad predomina en varones con antecedentes atópicos y se manifiesta en el niño pequeño con vómitos, dolor abdominal o rechazo a la alimentación y en el niño mayor como disfagia y/o impactación de alimentos. El tratamiento que ha demostrado una remisión más duradera, tanto clínica como histológica, es la terapia de exclusión alimentaria y, en los casos necesarios, esteroides (tópicos/sistémicos). Desconocemos cuál será el papel de las terapias inmunomoduladoras como la anti-IL5 (mepolizumab). Los escasos estudios con probióticos, heterogéneos en cuanto a cepas, duración y dosis, no han obtenido resultados.
SUPLEMENTACIÓN DE FÓRMULAS LÁCTEAS INFANTILES
Hay tres distintos enterotipos de microbiota en la población humana (proyecto MetaHIT-metagenómica del tracto intestinal humano) estables y definidos independientes de cualquier factor. Son como una “huella biológica”, como el grupo sanguíneo, que permitirá en el futuro un asesoramiento e intervención médica, dietética y preventiva personalizados. El perfil microbiano que consideramos estándar (el de una microbioma beneficiosa) es el de los recién nacidos a término, vía vaginal y alimentados exclusivamente con leche materna. Añadir a las fórmulas infantiles complementos probióticos y prebióticos perseguiría no solo conseguir una mayor similitud con la leche materna, sino también mejorar la función gastrointestinal e inmunitaria, evitando complicaciones a largo plazo.
En relación a los beneficios de las fórmulas suplementadas con probióticos administradas a lactantes menores de 4-6 meses, una revisión reciente del Comité de expertos de la Sociedad Europea de Gastroenterología, Hepatología y Nutrición Pediátrica (ESPGHAN)16 estableció, ateniéndose a la evidencia disponible, que podía haber un modesto beneficio tanto en la frecuencia como en la consistencia de las deposiciones con la aportación de Lactobacillus GG. En los lactantes mayores, los posibles beneficios serían sobre las infecciones gastrointestinales (B. lactis), disminución en el empleo de antibióticos (B. lactis y S. thermophilus o L. reuteri) y en la irritabilidad del cólico del lactante (B. lactis o S. thermopilus).
En cuanto a los prebióticos cabe comentar que, si bien no se han encontrado efectos adversos y que consideramos que su suplementación en la dieta tiene la capacidad de incrementar el número de bifidobacterias beneficiosas en las heces y disminuir la consistencia de las heces (efecto beneficioso en el estreñimiento), no se puede hacer una recomendación general sobre su uso. Es importante recordar que, a pesar de la ausencia de efectos adversos, será necesaria mucha más información antes de que podamos hacer un uso generalizado en niños prematuros o con problemas especiales como inmunodeficiencias.
OBESIDAD
Estudios en modelos animales, fundamentalmente en ratones, han demostrado que la microbiota tiene un papel no solo en la homeostasis lipídica y glucídica, sino que también participa en el desarrollo de la masa adiposa y en el estado de inflamación sistémica, de bajo grado, que condiciona la aparición de resistencia insulínica y de diabesidad.
Por otra parte, las características de la microbiota de los niños parecen predecir a edad muy temprana la aparición posterior de sobrepeso; un predominio de estafilococos parece indicar una obesidad futura, mientras que en niños que de adultos presentarían un peso normal se constata un mayor número de bifidobacterias (ver la clasificación taxonómica en la Tabla 2). También la presencia de alteraciones en la flora de mujeres embarazadas comporta mayor riesgo de tener un recién nacido de peso elevado, lo cual es un factor predictivo para el desarrollo de obesidad infantil. Son diversos los estudios sobre el efecto que la modulación de la flora intestinal tras la administración de probióticos (fundamentalmente con Bifidobacterium spp.) tendría en la prevención y/o tratamiento de la obesidad, hallándose estas líneas de investigación en sus estadios iniciales. Otros estudios han mostrado la relación entre ingesta de probióticos e incremento de peso particularmente con probióticos que contienen contienen Firmicutes, en particular al Lactobacillus spp (dominio Bacteria, filo Firmicutes): la toma de Lactobacillus sppn se asocia a un aumento de peso en aquellos niños que los han recibido en episodios de diarrea y la de probióticos conteniendo L. rhamnosus puede también ocasionar aumento de peso en los niños, independientemente de la enfermedad para la que este probiótico fue prescrito. Considerando la epidemia de obesidad infantil que se está produciendo en muchos países desarrollados y también en una buena parte de los países en desarrollo, deberíamos exigir un completo estudio de los efectos de los probióticos sobre el peso corporal y que se incluyera este aspecto en todas las patologías estudiadas en el futuro, como ya han reclamado algunos autores17.
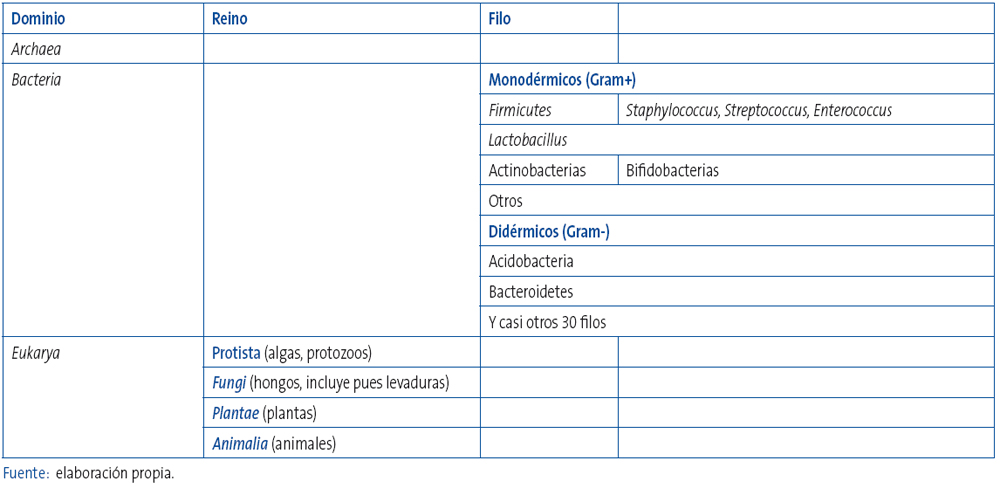
Tabla 2. Clasificación de los seres vivos. Mostrar/ocultar
Resumiendo, si bien parece existir una relación entre peso corporal y la microbiota intestinal, teniendo en cuenta que son pocos los estudios de intervención realizados, que muchos son observacionales y ateniéndonos a los criterios de medicina basada en la evidencia, es imposible hoy por hoy saber si las modificaciones de la microbiota son causa o consecuencia.
Pasamos pues a revisar en profundidad los conocimientos actuales que sobre este tema tenemos, de forma que ello nos permita interpretar los nuevos conocimientos que sin duda irán apareciendo en el futuro.
HABLANDO CON PROPIEDAD O ASPECTOS BÁSICOS DE TAXONOMÍA
Uno de los aspectos que puede dificultar la revisión de este tema es el taxonómico. Utilizaremos la taxonomía filogenética de Carl Woese (1977), basada en la secuenciación del ARN ribosómico 16S, que divide actualmente a los seres vivos en tres dominios: bacterias (Bacteria), arqueas (Archaea) y eucariontes (Eukarya) (Tabla 2 ). En los dominios Archaeay Bacteria se incluyen los organismos procariotas, es decir, aquellos cuyas células no presentan un núcleo celular bien diferenciado, mientras que en el dominio Eukarya se incluyen las formas de vida más conocidas y complejas, en donde las células tienen perfectamente definida la estructura nuclear y que son protistas, animales, hongos y plantas. Aunque el término "bacteria" se aplicó tradicionalmente a todos los microorganismos procariotas, la filogenia molecular ha podido demostrar que los microorganismos procariotas se dividen en dos dominios originalmente denominados Eubacteria y Archaebacteria, y ahora renombrados, como hemos dicho, como Bacteria y Archaea, que evolucionaron independientemente desde un ancestro común. Estos dos dominios, junto con el dominio Eukarya, constituyen la base del sistema de tres dominios citado, que es el sistema de clasificación más ampliamente utilizado en bacteriología. Cuando estamos hablando de un microorganismo, debemos ser capaces de clasificarlo en el dominio correspondiente, el reino, el filo, la clase, el orden, el género y la especie. Recordemos que: 1) escribimos en mayúscula el nombre del género y en minúscula el de la especie; 2) cuando nos referimos en general a todas las especies y subespecies de un género, sin especificar de cuál de elles se trata, utilizamos la abreviatura spp. o sp., y 3) por último no podemos olvidar que la clasificación de muchos microorganismos ha cambiado a medida que han avanzado nuestros conocimientos. Así, por ejemplo, antes de la década de los sesenta, las especies de Bifidobacterium eran denominadas colectivamente Lactobacillus bifidus.
Como ya dijimos en la primera parte, el intestino humano alberga aproximadamente unos 100 trillones de microorganismos18, de más de 400 especies bacterianas. De hecho, más de la mitad del peso de la materia que se encuentra en el colon no es otra cosa que células bacterianas, cuyo número es diez veces superior al de las células de los tejidos que constituyen el cuerpo humano. El genoma de esta población tiene una capacidad codificante muy superior a la del genoma humano (150 veces mayor), aportándonos funciones metabólicas adicionales19. Algunos de estos microorganismos, fundamentalmente bacterias y levaduras (dominio: Eucariota; reino: Fungi) son probióticas.
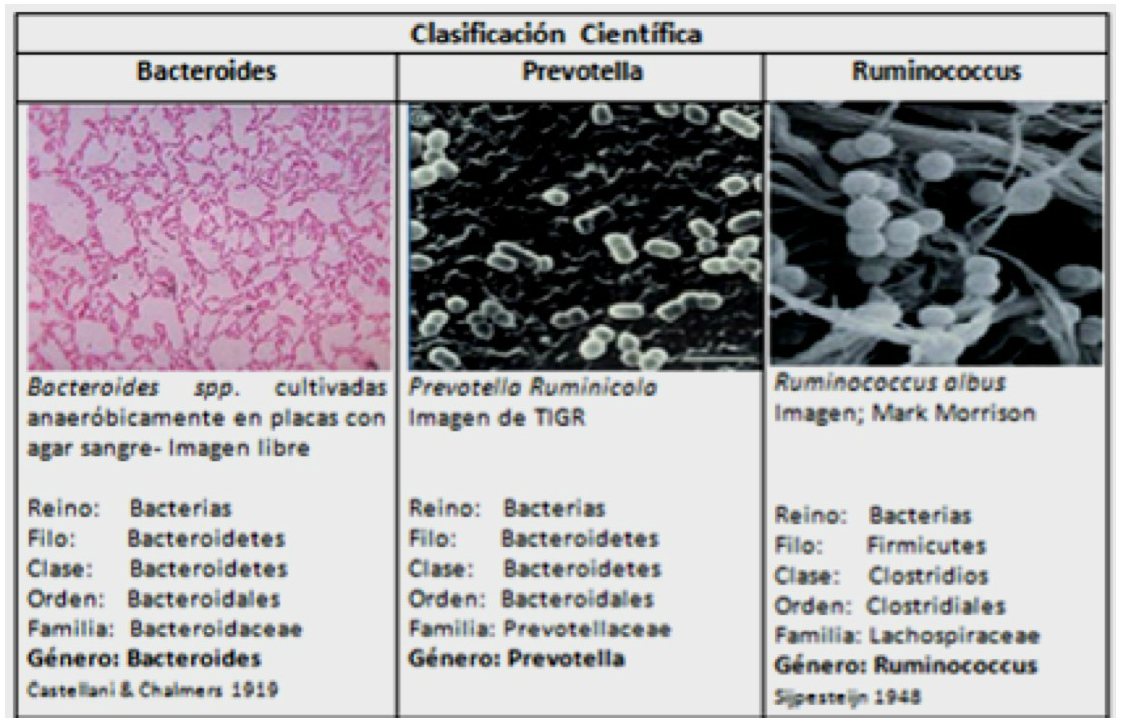
Describir la composición de la microbiota del intestino así como sus funciones biológicas y su relación con posibles enfermedades como la obesidad y la diabetes asociada en humanos, tiene un gran interés. El proyecto europeo MetaHIT tiene como objetivo central no solo establecer nuevas hipótesis de asociaciones entre el microbioma del intestino, la salud y la enfermedad de las personas, sino comprender los mecanismos subyacentes y las interacciones del huésped con los microorganismos que alberga. Este estudio estableció que existen tres grandes grupos de poblaciones en el intestino que no se relacionan con la edad, sexo, nacionalidad o dieta. Se ha llamado a estos tres enterotipos por el género microbiano predominante: Bacteroides, Prevotella y Ruminococcus (Figura 1 ). En el primer enterotipo predominan las bacterias del género Bacteroides, que forman una comunidad bien diferenciada. El enterotipo 2 está dominado por las bacterias Prevotella, mientras que el enterotipo 3 esta dominado por Ruminococcus, aunque también contiene especies bacterianas como Staphylococcus y Gordonibacter. Al parecer, el enterotipo más frecuente es este último.
Figura 1. Microorganismos predominantes en la flora intestinal. Mostrar/ocultar
COMPRENDIENDO EL MECANISMO POTENCIAL ENTRE PROBIOTA Y CONTROL DEL PESO CORPORAL
La presencia de unos gérmenes u otros da lugar a que se puedan o no descomponer materiales que alcanzan el intestino grueso proporcionando energía suplementaria y micronutrientes que podría aprovechar el ser humano. Así, por ejemplo, el enterotipo 3 está especializado en la descomposición de mucina, proteína producida por las células epiteliales en todas las mucosas del organismo. La descomposición de la mucina comportaría que pudieran ser absorbidos sus nutrientes, fundamentalmente aminoácidos y/o una mayor generación de energía. Por otra parte, la producción de vitaminas es distinta en cada uno de los enterotipos: mientras que el enterotipo 1 produce vitamina B7 (biotina), B2 (riboflavina) y C (ácido ascórbico), el enterotipo 2 produce vitamina B1 (tiamina) y ácido fólico. Así pues, cada enterotipo da lugar a una manera distinta de producir energía. Estos hallazgos podrían ser en el futuro el primer eslabón hacia un asesoramiento médico y dietético preventivo personalizado.
Aunque la revisión de los complejos mecanismos que vinculan a la obesidad con la microbiota y viceversa escapan a este tema, destacan la posibilidad de obtener energía, por ejemplo degradando por fermentación hidratados de carbono complejos, que de otro modo se perderían con las heces, la producción de lipopolisacáridos (LPS), los cuales inducen un estado de inflamación crónica, una modulación en la expresión de los genes del huésped de acogida y una mayor secreción de péptidos intestinales, etc. Cada uno de estos factores comporta a su vez múltiples consecuencias; así, por ejemplo, el aumento de la capacidad para la degradación (fermentación) de hidratos de carbono, a la que hacíamos referencia, aumenta la cantidad de ácidos grasos de cadena corta (AGCC) tales como acetato, propionato, butirato, y L-lactato. Estos AGCC tienen papeles importantes en la reducción del pH intestinal, en la regulación del metabolismo de la energía, la inmunidad, la expansión del tejido adiposo y en la modulación de desarrollo de las células del cáncer. El butirato se utiliza como un sustrato de energía para los colonocitos, el acetato como un precursor de ácido graso y colesterol y el propionato como sustratos de la gluconeogénesis en el hígado. Además de estas funciones, los AGCC son también ligandos fisiológicos de G-receptores que se acoplan a las proteínas GPR43 y 41 (también llamados receptor de ácido graso libre 2 y 3, respectivamente), que se expresan en varios tipos de células (células inmunes, células endocrinas y adipocitos) de los tejidos del huésped. La activación de GPR43 por la AGCC contribuye a la inhibición de la lipólisis y de la diferenciación de adipocitos y, por tanto, al aumento del tejido adiposo.
Los monosacáridos producidos por fermentación microbiana aumentan la transcripción de varias proteínas implicadas en la lipogénesis hepática, contribuyendo así a la acumulación de grasa hepática y a la consabida esteatosis no alcohólica. Estos mecanismos, descritos inicialmente en modelos animales, han sido probados en estudios humanos. Así Jumpertz et al.20 informaron de que la cantidad de energía que puede extraerse de las heces se correlaciona positivamente y negativamente, respectivamente, con la abundancia de filoBacteroidetes y filoFirmicutes en las heces. Podríamos obtener aproximadamente un incremento de unas 150 kcal con un incremento de un 20% en Firmicutes y una disminución semejante en caso de que hubiera un incremento del 20% en los Bacteroidetes. Así pues, el exceso de calorías tomadas en forma de AGCC por fermentación microbiana de contenido luminal puede ser un factor que contribuye a la obesidad.
Complementariamente a los datos aportados por el proyecto MetaHIT, se habían ido acumulando distintos estudios independientes en modelos animales21,22 que reforzaban la hipótesis de una posible asociación entre la microbiota, la regulación del peso corporal y las enfermedades asociadas a la obesidad, dada su posible influencia en las funciones metabólicas20,22 e inmunológicas del hospedador.
En 2004, Bached et al.21 mostraron que los ratones libres de gérmenes, a pesar de consumir un 30% más de alimento que sus congéneres convencionales (con microbiota), tenían un 42% menos de grasa total y que al ser colonizados por la microbiota de ratones convencionales, incrementaban, en solo diez días, su grasa corporal total en un 57%; de esta manera, a las dos semanas habían desarrollado resistencia a la insulina y todo ello sucedía pese a la disminución del consumo de alimentos y al aumento de actividad a los que se les sometió durante el estudio. Posteriormente, en otras investigaciones sobre la microbiota en modelos animales, que comparan individuos genéticamente delgados u obesos, se estableció una relación entre obesidad y una mayor proporción de Archaea23.
Otros estudios evidenciaron una reducción en Bifidobacterium y un aumento en Halomonas y Sphingomonas en la microbiota intestinal de animales genéticamente obesos (fa/fa) en comparación con individuos control24.
En otros estudios animales de intervención, como el referido antes de Bached, mostraron que las alteraciones en la composición de la microbiota intestinal asociadas a la obesidad en animales (bien genética o inducida por la dieta) pueden revertirse, al menos a corto plazo, mediante la transferencia por vía oral de la microbiota intestinal de individuos delgados o, incluso, con la administración de algunos prebióticos25.
Un estudio financiado en parte por el proyecto BIOCLA (producción de derivados lácteos enriquecidos con ácido linoleico conjugado [CLA] por métodos naturales) concluyó que la administración de determinados Lactobacillus, capaces de sintetizar CLA, pueden modular la fisiología de los adipocitos cambiando significativamente su composición26. Estos resultados pusieron en evidencia que la ingesta de bacterias vivas puede tener un efecto potencial en la actividad metabólica de partes distantes en el organismo. Se abrió pues la posibilidad de plantear, como hipótesis, que la manipulación intencionada de la microbiota intestinal a través de la dieta pudiera ser una posible nueva herramienta para prevenir o modificar el riesgo de obesidad y de las enfermedades que a ella se asocian. Ahora bien, además de que ningún estudio en modelo animal (o modelo celular) nos permite establecer una relación causal, tampoco podemos extrapolar sus resultados a humanos. Esta afirmación se ve aún más sustentada tras revisar el metaanálisisde Onakpoya27 sobre el uso del CLA en humanos, el cual no mostró ningún efecto convincente sobre la composición corporal.
El estudio de Ley, publicado en Nature en 200628, no solo observó que había cambios en la flora de los humanos obesos (cambios en la proporción entre Firmicutes y Bacteroidetes), sino que también constató que tras seguir una dieta hipocalórica y baja en hidratos de carbono o en grasas, se produjo un aumento de presencia de Bacteroidetes; este aumento en Bacteroidetes fue paralelo a la pérdida de peso durante el periodo de intervención que fue de un año. Estudios posteriores en población adolescente obesa, sometida a un tratamiento multidisciplinario para combatir la obesidad basado en una dieta con restricción calórica y un aumento de la actividad física, también pusieron en evidencia la relación entre el peso corporal y la composición de la microbiota.
El estudio de Santacruz29 se realizó en una treintena de adolescentes observando dos hechos:
- La composición de la microbiota de partida pareció influir en la pérdida de peso
- La proporción relativa de los grupos Bacteroides-Prevotella y Lactobacillus aumentó, mientras que la de los grupos Clostridium histolyticum, Clostridium lituseburense y Eubacterium rectale C coccoides disminuyó tras la intervención en aquellos individuos que sí experimentaron una pérdida significativa de peso. Estos resultados estaban en línea con los obtenidos en gemelos obesos y delgados por otros autores, pues en los primeros encontraban una menor proporción de Bacteroidetes y una mayor de Actinobacterias30.
El grupo de Ilmonen et al. evidenció que las mujeres embarazadas que tomaban suplementos probióticos (lactobacillus y bifidobacterium) a partir del tercer trimestre del embarazo tenían una menor propensión a desarrollar posteriormente obesidad central (perímetro de cintura > 80 cm). Este fue, de hecho, el primer estudio que estableció una posible relación entre la toma de una dieta complementada con probióticos durante el embarazo y la lactancia y la presencia de adiposidad central en el año posterior al parto. Este grupo llegó a sugerir que el consumo de probióticos, junto a una dieta equilibrada, era un método razonablemente seguro, práctico y económico para ser usado con otros factores de estilo de vida en el control de la adiposidad central.
Diversos estudios en población pediátrica31 evalúan los resultados de una intervención con probióticos en los niveles lipídicos sin observar resultados.
DIVERSIDAD BACTERIANA E INTERVENCIÓN DIETÉTICA
Otro factor determinante en la génesis de diversas enfermedades podría ser la diversidad microbiana.
Los individuos con menor diversidad, como las personas poco activas32, obesas y/o con enfermedad inflamatoria intestinal tienden a presentar una mayor adiposidad, resistencia insulínica, dislipemia y un fenotipo inflamatorio más pronunciado comparado con aquellos con alta diversidad33.
Raoult17 describió que en algunos estudios en los que se había administrado como probiótico Lactobacillus spp. (Bifidobacterium spp.) a niños aquejados de diarrea, aquella administración se había asociado con un incremento de peso. También constató que la administración de Lactobacillus rhamnosus como probiótico, independientemente de la enfermedad o prevención de enfermedad por la que había sido prescrita su administración, podía comportar aumento de peso en niños. Dados estos resultados y teniendo en cuenta la pandemia de obesidad infantil, fueron y han sido diversas las voces que han exigido un completo estudio de los probióticos sobre el peso corporal. En este contexto, en septiembre del 2009 el investigador francés Didier Raoult17 realizó unos controvertidos comentarios en el editorial de la prestigiosa revista anglosajona Nature Reviews: Microbiology, postulando la relación causal entre ingesta de probióticos y obesidad. En diciembre del mismo año, tres investigadores (Ehrlich, Delzenne y Reid)34 realizaron en la misma revista duras críticas a los comentarios realizados por Raoult. Las líneas de crítica fundamentales fueron:
- Que el aumento de peso observado en los animales de granja tras la administración de probióticos respondía a un aumento de la masa magra debido a la mejora a la resistencia a las infecciones (y por lo tanto a una menor cantidad de diarreas) y no al aumento de masa grasa debido a un presunto desequilibrio metabólico.
- Que la hipótesis se había hecho sin que la búsqueda bibliográfica hubiera sido sistemática y exhaustiva, de forma que se habían omitido estudios que daban resultados sobre el peso neutros o incluso contrarios. La polémica estaba servida.
Este debate llegó a los medios de información generales un par de años después, de manera que en mayo del 2012 apareció de forma masiva en los medios de comunicación no especializados un artículo en el que se postulaba que la ingesta de probióticos podía suponer un riesgo para la salud de la población al agravar y/o fomentar uno de los problemas de salud pública más preocupantes en este momento, la obesidad. Ello motivó muchas incertidumbres en la población y solicitudes de información en la consulta diaria de Pediatría.
El equipo de Didier respondió a esta controversia científica publicando el 24 de mayo de 2012, en el número 2 de la revista Microbial Pathogenesis, un metaanálisis35 en el que volvían a poner sobre la mesa el debate. Este estudio tenía serias limitaciones metodológicas (algunas de ellas reconocidas por los propios autores), siendo la más importante la de haber mezclado estudios en humanos y en animales en el análisis de los datos. Aunque en el estudio se reconocía que cuando se analizaban los datos en el grupo humano los resultados no eran significativos, en las conclusiones del estudio se ponían de relieve los resultados del análisis conjunto (estudios en animales y en humanos), relacionando ingesta de probióticos con obesidad.
Meses después, en septiembre de 2012, apareció en lengua española el artículo titulado “Efecto de los probióticos en el control de la obesidad en humanos: hipótesis no demostradas”, que se publicó en la Revista Española de Nutrición Humana y Dietética36. Este artículo fue elaborado por un estudiante de postgrado, con la supervisión del grupo de Guarner, y remitido en septiembre del 2011 a la editorial de la revista, es decir, tras la polémica científica pero antes de que estallara la polémica alarma en la prensa generalista. Dos semanas después de aparecer esta, se acepta su publicación (7 de junio de 2012) afirmándose en este artículo que si bien “se necesitan más estudios para evaluar los efectos d,e los probióticos en la incidencia de obesidad, si las relaciones establecidas entre la microbiota intestinal, el metabolismo y la inmunidad se demostraran mediante ensayos clínicos en humanos, el uso de estrategias dietéticas destinadas a modular la composición de la microbiota basadas en probióticos podría contribuir al control de los trastornos metabólicos de forma más eficaz y se abrirían nuevas puertas de estudio para obtener un mejor conocimiento de la biología humana y las numerosas aplicaciones en la salud y la nutrición humana”. Queremos remarcar que, si bien este fue un muy buen estudio de revisión, no se realizó un metaanálisisde los estudios tras una revisión sistemática y exhaustiva de las fuentes de información según criterios de medicina basada en la evidencia.
Así pues, podemos concluir que la modulación de la microbiota intestinal podría afectar los mecanismos de producción de energía en el colon. Creemos que esto podría ser la base de una estrategia más para combatir la obesidad; los mismos conocimientos, por qué no, podrían servirnos para aumentar el aprovechamiento energético si en un futuro esta fuera la necesidad de la humanidad, cuya población es exponencialmente creciente.
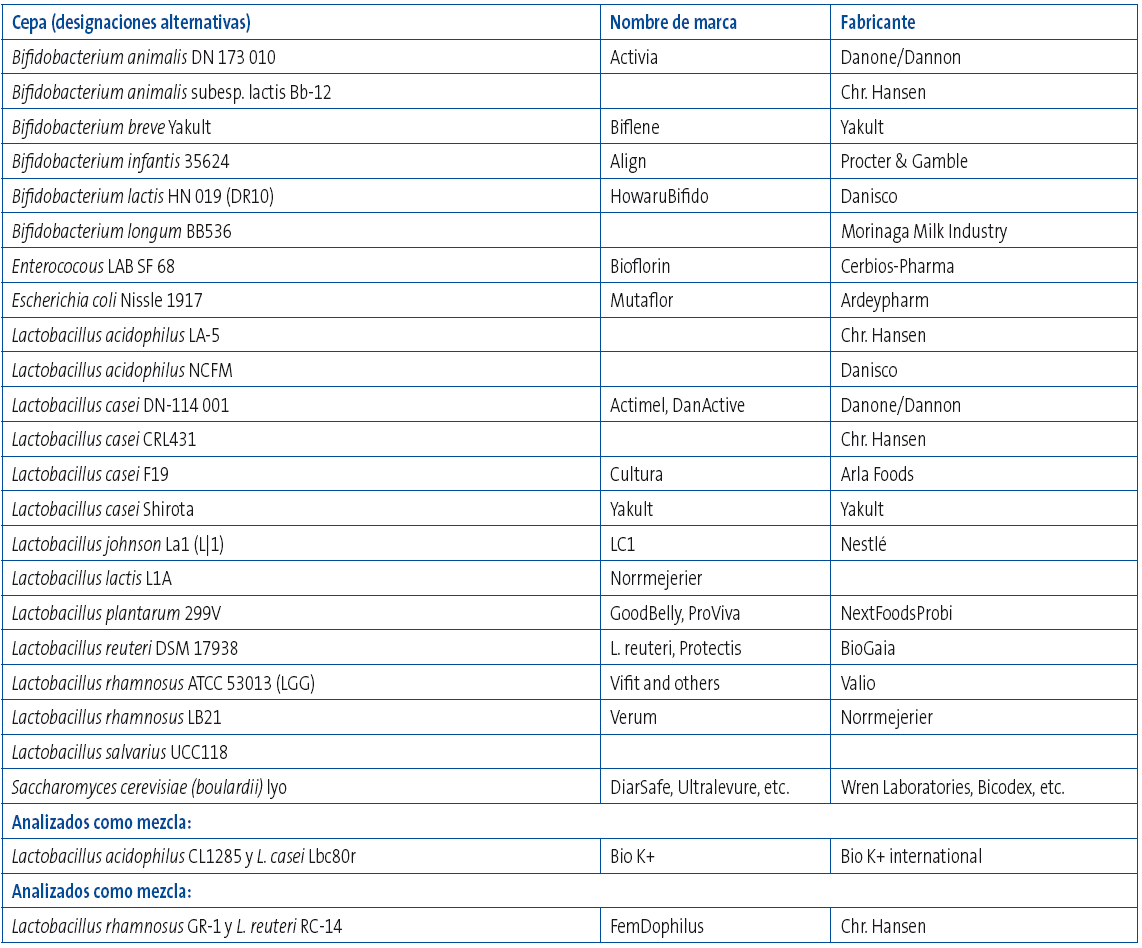
En la tabla 3 se puede consultar un listado no exhaustivo de productos probióticos.
Tabla 3. Listado no exhaustivo de productos probióticos. Mostrar/ocultar
FUNCIÓN DEL PEDIATRA DE ATENCIÓN PRIMARIA
Desde un punto de vista práctico, corresponde al pediatra adaptar estos conocimientos basados en la evidencia de que disponemos a consejos e indicaciones de aspecto práctico. Podríamos resumirlas de la siguiente manera:
- La leche materna, con grandes cantidades de prebióticos, fundamentalmente oligosacáridos, debería ser el alimento de elección, siempre que se pueda, y exclusivo durante los primeros seis meses de vida. Con ello favorecemos que el lactante tenga una flora intestinal bifidogénica y por tanto protectora. Un uso racional y adecuado de los antibióticos a lo largo de la vida favorecerá la presencia de una adecuada flora intestinal.
- Descartaremos (inicialmente) el uso de los probióticos en pacientes con factores de inmunosupresión, tanto si están recibiendo tratamiento como si no, que sean portadores de catéteres venosos centrales o presenten alteraciones congénitas del metabolismo, etc.
-
En niños sanos hay evidencias de su utilidad en:
- Reducir la diarrea aguda vírica, si se administran precozmente, además del tratamiento de rehidratación. Cepas Lactobacillus GG o Sacharomyces boulardii, a dosis superiores a 1010 UFC.
- Prevenir la diarrea asociada a antibióticos.
- Prevención de la dermatitis atópica utilizando un tratamiento secuencial que, de realizarse debe empezar antes del parto, para ser eficaz.
- No hay datos suficientes para recomendar el uso “rutinario” de probióticos y prebióticos en las fórmulas para lactantes.
- Los prebióticos en la alimentación complementaria tienen escasas repercusiones beneficiosas, salvo el cambio en la cantidad y en la consistencia de las heces.
- La prevención de la enterocolitis necrotizante (ECN) en recién nacidos petérmino ≤ 32 ssemanas y peso entre 1000 y 1500 con el uso monitorizado de probióticos.
- Coadyuvante en el tratamiento erradicador de la Helicobacter pylori.
- En la terapia de mantenimiento de la pouchitis.
- En la intolerancia a la lactosa.
-
No hay ninguna evidencia para recomendarlos en:
- Prevención de la diarrea aguda infecciosa.
- Tratamiento de la diarrea asociada a antibióticos.
- Tratamiento de la dermatitis atópica.
- Tratamiento o prevención del asma.
- Rinitis no alérgica o rinosinusitis crónica.
- Tratamiento o prevención de las alergias alimentarias.
- Tratamiento o prevención de la enfermedad de Crohn.
- Prevención neumonías asociadas a ventilación mecánica.
-
A pesar de resultados prometedores, necesitamos más estudios en:
- Colitis ulcerosa.
- El tratamiento del sobrecrecimiento bacteriano.
- La optimización de la función intestinal y respiratoria en la fibrosis quística.
- Rinitis alérgica.
- Recoger de forma sistemática y exhaustiva la información en aquellos pacientes en los que se prescriban, incluyendo indicación, cepa, dosis y duración administradas, así como los parámetros antropométricos.
- Trabajar mediante la evidencia científica, de forma que nuestra prescripción en la práctica clínica, tanto dietética como de otra índole, se ajuste a ella. Para algunos esto significará tener que esperar el tiempo necesario para que se establezca una recomendación que sea improbable que varíe con el tiempo; para otros no esperar más para introducir ya un cambio cuyo beneficio es evidente.
BIBLIOGRAFÍA
- Kalliomäki M, Salminen S, Arvilommi H, Kero P, Koskinen P, Isolauri E. Probiotics in primary prevention of atopic disease: a randomized placebo-controlled trial. Lancet. 2001;357:1076-9.
- Kalliomäki M, Salminen S, Poussa T, Arvilommi H, Isolauri E. Probiotics and prevention of atopic disease: 4-year follow-up of a randomised placebo-controlled trial. Lancet. 2003;361:1869-71.
- Kukkonen K, Savilahti E, Haahtela T, Juntunen-Backman K, Korpela R, Poussa T, et al. Probiotics and prebiotic galacto-oligosaccharides in the prevention of allergic diseases: a randomized, double-blind, placebo-controlled trial. J Allergy Clin Immunol. 2007;119:192-8.
- Taylor AL, Hons BSc Dunsatan JA, Prescott SL. Probiotic supplementation for the first 6 months of life fails to reduce the risk of atopic dermatitis and increase the risk of allergen sensitization in high-risk children: a randomized controlled trial. J Allergy Clin Immunol. 2007;119:184-91.
- Kopp MV, Hennemuth I, Heinzmann A, Urbanek R. Randomized, double-blind, placebo-controlled trial of probiotics for primary prevention: no clinical effects of Lactobacillus GG suplementation. Pediatrics. 2008;121;e850-6.
- Abrahamsson TR, Jakobsson T, Böttcher MF, Fredrikson M, Jenmalm MC, Björkstén B, et al. Probiotics in prevention of IgE-associated eczema: a double-blind, randomized, placebo-controlled trial. J Allergy Clin Immunol. 2007;119:1174-80.
- Doege K, Grajecki D, Zyriax BC, Detinkina E, Zu Eulenburg C, Buhling KJ. Impact of maternal supplementation with probiotics during pregnancy on atopic eczema in childhood–a meta-analysis. Br J Nutr. 2012;107:1-6.
- Pelucchi C, Chatenoud L, Turati F, Galeone C, Moja L, Bach JF, et al. Probiotics supplementation during pregnancy or infancy for the prevention of atopic dermatitis: a meta-analysis. Epidemiology. 2012;23:402-14.
- Panduru M, Panduru NM, Sălăvăstru CM, Tiplica GS. Probiotics and primary prevention of atopic dermatitis: a meta-analysis of randomized controlled studies. J Eur Acad Dermatol Venereol. 2015;29:232-42.
- Elazab N, Mendy A, Gasana J, Vieira ER, Quizon A, Forno E. Probiotic administration in early life, atopy, and asthma: a meta-analysis of clinical trials. Pediatrics. 2013;132:e666-76.
- Forno E, Onderdonk AB, McCracken J, Litonjua AA, Laskey D, Delaney ML, et al. Diversity of the gut microbiota and eczema in early life. Clin Mol Allergy. 2008;6:11.
- Zheng T, Yu J, Oh Mh, Zhu Z. The atopic march:progression from atopic dermatitis to allergic rinitis and asthma. Allergy Asthma Immunol Res. 2011;3;67-73.
- Abrahamsson Tr, Jakobsson He, Andersson AF, Bjorksten b, Engstrand L. Low diversity of the gut microbiota in infants with atopic eccema. J Allergy Clin Immunol. 2012; 129:434-40.
- Osborn DA, Sinn JKH. Probiotics in infants for prevention of allergic disease and food hypersensitivity.Cochrane Database Syst Rev. 2007 Oct 17;(4):CD006475.
- Azad MB, Coneys JG, Kozyrskyj AL, Field CJ, Ramsey CD, Becker AB, et al. Probiotic supplementation during pregnancy or infancy for the prevention of asthma and wheeze: systematic review and meta-analysis. BMJ. 2013;347:f6471.
- Braegger C, Chmielewska A, Decsi T, Kolacek S, Mihatsch W, Moreno L, et al. Supplementation of infant formula with probiotics and/or prebiotics: a systematic review and comment by the ESPGHAN committee on nutrition. J Pediatr Gastroenterol Nutr. 2011;52:238-50.
- Raoult D. Probiotics and obesity: a link? Nat Rev Microbiol. 2009;7:616.
- Goldin BR. Intestinal microflora: Metabolism of drugs and carcinogens. Ann Med. 1990;22:43-8.
- Tremaroli V, Backhed F. Functional interactions between the gut microbiota and host metabolism. Nature. 2012;489:242-9.
- Jumpertz R, Le DS, Turnbaugh PJ, Trinidad C, Bogardus C, Gordon JI, Krakoff J. Energy-balance studies reveal associations between gut microbes, caloric load, and nutrient absorption in humans. Am J Clin Nutr. 2011;94:58-65.
- Backhed F, Ding H, Wang T, Hooper LV, Koh GY, Nagy A, et al. The gut microbiota as an environmental factor that regulates fat storage. Proc Natl Acad Sci USA. 2004;101:15718-23.
- Cani PD, Bibiloni R, Knauf C, Waget A, Neyrinck AM, Delzenne NM, et al. Changes in gut microbiota control metabolic endotoxemia-induced inflammation in high-fat diet-induced obesity and diabetes in mice. Diabetes. 2008;57:1470-81.
- Ley RE, Bached F, Turnbaugh P, et al. Obesity alters gut microbial ecology. Proc Natl Acad Sci USA. 2005;102:11070-5.
- Waldram A, Holmes E, Wang Y, Rantalainen M, Wilson ID, Tuohy KM, et al. Top-down systems biology modelling of host metabotype-microbiome associations in obese rodents. J Proteome Res. 2009;8:2361-75.
- Cani PD, Neyrinck AM, Fava F, Knauf C, Burcelin RG, Tuohy KM, et al. Selective increases of bifidobacteria in gut microflora improve high-fat-diet-induced diabetes in mice through a mechanism associated with endotoxaemia. Diabetologia. 2007;50:2374-83.
- Rosberg-Cody E, Stanton C, O'Mahony L, Wall R, Shanahan F, Quigley EM, et al. Recombinant lactobacilli expressing linoleic acid isomerase can modulate the fatty acid composition of host adipose tissue in mice. Microbiology. 2011;157:609-15.
- Onakpoya IJ, Posadzki PP, Watson LK, Davies LA, Ernst E. The efficacy of long-term conjugated linoleic acid (CLA) supplementation on body composition in overweight and obese individuals: a systematic review and meta-analysis of randomized clinical trials. Eur J Nutr. 2012;51:127-34.
- Ley RE, Turnbaugh PJ, Klein S, Gordon JL. Microbial ecology: human gut microbes associated with obesity. Nature. 2006;444:1022-3.
- Santacruz A, Marcos A, Wärnberg J, Martí A, Martin-Matillas M, Campoy C, et al. Interplay between weight loss and gut microbiota composition in overweight adolescents. Obesity (Silver Spring). 2009;17:1906-15.
- Turnbaugh PJ, Hamady M, Yatsunenko T, et al. A core guts microbiome in obese and lean twins. Nature. 2009;457:480-4.
- Sanz Y, Santacruz A, Dalmau J. Influencia de la microbiota intestinal en la obesidad y las alteraciones del metabolismo. Acta Pediatr Esp. 2009;67:437-42.
- Clarke SF, Murphy EF, O’Sullivan O, Lucey AJ, Humphreys M, Hogan A, et al. Exercise and associated dietary extremes impacto on gut microbial diversity. Gut. 2014;63:1913-20.
- Goootland M. El papel de la microbiota intestinal en el desarrollo de la obesidad y de la diabetes de tipo 2. Rev Chil Endocrinol Diabetes. 2013;6:155-62.
- Ehrlich SD. Probiotics-little evidence for a link to obesity. Nat Rev Microbiol. 2009;7:901.
- Million M, Angelakis E, Paul M, Armougom F, Leibovici L, Raoult D. Comparative meta-analysis of the effect of Lactobacillus species on weight gain in humans and animals. Microb Pathog. 2012;53:100-8.
- Arias A, Mach N. Efecto de los probióticos en el control de la obesidad en humanos: hipótesis no demostradas. Rev Esp Nutr Hum Diet. 2012;16:100-7.