Sumario
Uso racional de las pruebas diagnósticas
2016, vol. 9, nº 3
Test de Graham
Autores: Sánchez Marco SB1, Cenarro Guerrero MT2
1 Pediatra Atención Primaria. Servicio de Pediatría. Hospital Infantil Miguel Servet. Zaragoza. (España).
2 Pediatra Atención Primaria. Servicio de Pediatría. CS Muñoz y Fernández. Zaragoza (España).
1 Pediatra Atención Primaria. Servicio de Pediatría. Hospital Infantil Miguel Servet. Zaragoza. (España).
2 Pediatra Atención Primaria. Servicio de Pediatría. CS Muñoz y Fernández. Zaragoza (España).
INTRODUCCIÓN
La enterobiasis es una infección producida por el nematodo Enterobius vermicularis, siendo una de las parasitosis más frecuentes en la edad pediátrica. La prevalencia varía entre el 4-28%, siendo más frecuente en climas templados y en instituciones (guarderías, colegios, etc.).
El gusano se localiza a nivel del tracto digestivo del huésped y la hembra migra durante la noche a las regiones perineal y perianal, donde deposita hasta 15 000 huevos. La transmisión se produce por un mecanismo feco-oral, al ingerir estos huevos presentes en las uñas, las sábanas o el polvo doméstico.
Clínicamente puede cursar de forma asintomática o producir prurito anal, irritabilidad, insomnio, vulvovaginitis y dolor abdominal o, menos frecuentemente, urticaria o dermatitis atópica entre otras manifestaciones. El diagnóstico se realiza por la visión directa del gusano o mediante la visión de los huevos depositados en el área perianal por medio del test de Graham (“prueba del celo”).
¿QUÉ ES?
El test de Graham es una prueba muy sencilla que permite diagnosticar la parasitación por nematodos. Esta prueba consiste en tomar una muestra de la región perianal con ayuda de una cinta adhesiva transparente para poder observar los huevos de este parásito y, de esta manera, hacer el diagnóstico. En la Tabla 1 se recogen sus ventajas e inconvenientes.
MATERIAL NECESARIO
- Portaobjetos.
- Cinta adhesiva transparente.
- Rotulador/etiqueta para identificar el portaobjetos.
Tabla 1. Ventajas e inconvenientes del test de Graham. Mostrar/ocultar
¿CUÁNDO DEBE REALIZARSE?
Se debe realizar por la mañana al levantarse, antes de orinar, defecar o bañarse. No se deben aplicar pomadas ni talcos en la región anal durante todo el proceso de la recolección de muestras. La aplicación en los niños, y en lo posible en los adultos también, debe efectuarla un familiar.
MÉTODO DE RECOGIDA DE LA MUESTRA
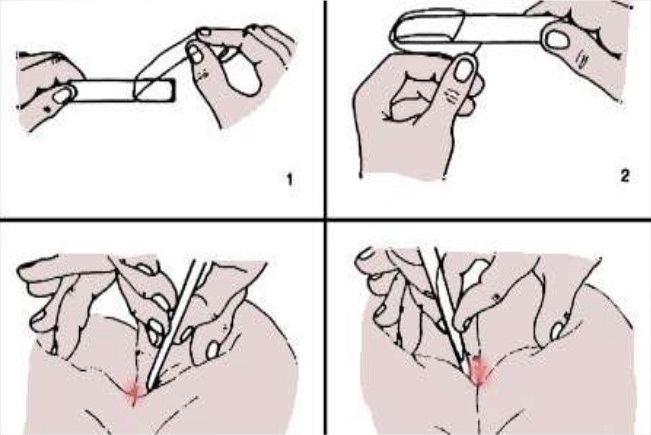
Se deben recoger tres muestras en tres días consecutivos (Figura 1):
- Separar los glúteos del paciente para que quede expuesta la región perianal, donde se localizan los huevos del nematodo.
- Aplicar la superficie adhesiva a la región anal y perianal.
- Retirar la cinta adhesiva y pegarla a lo largo del portaobjetos.
- Retirar los guantes y lavarse las manos tras la recogida de la muestra.
Figura 1. Esquema representativo de recogida de muestra. Mostrar/ocultar
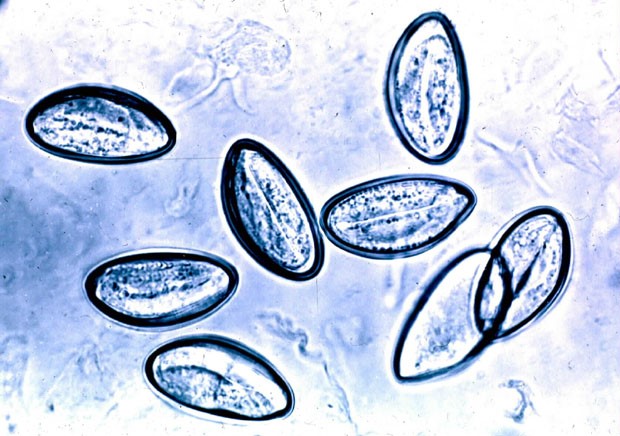
OBSERVACIÓN AL MICROSCOPIO
En caso de parasitosis se observarán los huevos de los nematodos adheridos al portaobjetos (Figura 2). En ocasiones, aunque es infrecuente, también se pueden visualizar gusanos adultos en la misma muestra.
Figura 2. Visualización directa de huevos de Enterobious vermicularis al microscopio óptico. Mostrar/ocultar
CUADERNO DEL PEDIATRA
- La infección por oxiuros es la parasitosis más frecuente en nuestro medio en la edad pediátrica.
- La sintomatología más frecuente incluye irritabilidad, insomnio, prurito anal de predominio nocturno, vulvovaginitis y dolor abdominal, entre otras manifestaciones.
- El diagnóstico se basa en la visualización directa de los gusanos en la región perianal y, en su ausencia, la realización del test de Graham.
- El test de Graham constituye una técnica rápida, sencilla y económica para el diagnóstico de esta parasitosis.
- A pesar de no presentar efectos secundarios ni contraindicaciones al ser una técnica no invasiva, presenta algunos inconvenientes como la posibilidad de falsos negativos (eliminación intermitente de parásitos o inadecuada recogida de la muestra) y un tiempo prolongado hasta obtener resultados (5-7 días).
BIBLIOGRAFÍA RECOMENDADA
- Aparicio Rodrigo A, Díaz Cirujano AI. Parasitosis intestinales. En: Guía ABE [en línea] [consultado el 08/09/2016]. Disponible en: http://www.guia-abe.es/temas-clinicos-parasitosis-intestinales
- Báez López N, Pereira Boan J, Ruiz Aliende S, Marne Trapero C. Prueba de Graham y enterobiasis; resultados de 11 años. Rev Pediatr Aten Primaria. 2013;15:53.
- Dent AE, Kazura JW. Enterobiasis (Enterobius vermicularis). En: Kliegman R, Stanton B, St. Geme J, Schor N, Behrman R. Nelson Textbook of Pediatrics. 19.ª edición. Filadelfia: Elsevier Saunders; 2011.
- Imbesi S, Casciaro M, Minciullo PL, Gangemi S. Association between skin manifestations and oxyuriasis. En: The Child [en línea] [consultado el 08/09/2016]. Disponible en: http://www.thechild.it/archives/2013/number1/print.php?id=4
- Maguire JH. Intestinal nematodes (roundworms). En: Bennett JE, Dolin R, Mandell GL (eds). Mandell, Douglas, and Bennett's principles and practice of infectious diseases. 8.ª edición. Filadelfia, PA: Elsevier Saunders; 2014.
- Medina Claros AF, Mellado Peña MJ, García López Hortelano M, Piñeiro Pérez R, Martín Fontelos P. Parasitosis intestinales. En: Protocolos diagnóstico-terapéuticos de la AEP [en línea] [consultado el 08/09/2016]. Disponible en: https://www.aeped.es/sites/default/files/documentos/parasitosis.pdf
- Norhayati M, Fatmah MS, Yusof S, Edariah AB. Intestinal parasitic infections in man: a review. Med J Malaysia. 2003;58:296-305.
- Parasites-Enterobiasis (also known as Pinworn infection). En: Centers for Disease Control and Prevention [en línea] [consultado el 08/09/2016]. Disponible en: http://www.cdc.gov/parasites/pinworm/
- Procesamiento de muestras para diagnóstico de parásitos intestinales. Proyecto AECID 2012. En: Telemicroscopia [en línea] [consultado el 08/09/2016]. Disponible en: http://www.telemicroscopia.ehas.org/assets/diagnostico-parasitos-intestinales.pdf