Sumario
Puesta al día en...
2018, vol. 11, nº 1
Hipertensión intracraneal idiopática en el niño (pseudotumor cerebri)
Autores: Monge Galindo L1, Baquedano Lobera I2, Fustero de Miguel D3, Pueyo Royo V4
1 Sección de Neuropediatría. Servicio de Pediatría. Hospital Infantil Universitario Miguel Servet. Zaragoza (España).
2 Sección de Neuropediatría. Servicio de Pediatría. Hospital Infantil Universitario Miguel Servet. Zaragoza (España).
3 Servicio de Neurocirugía. Hospital Infantil Universitario Miguel Servet. Zaragoza (España).
4 Servicio de Oftalmología. Hospital Infantil Universitario Miguel Servet. Zaragoza (España).
1 Sección de Neuropediatría. Servicio de Pediatría. Hospital Infantil Universitario Miguel Servet. Zaragoza (España).
2 Sección de Neuropediatría. Servicio de Pediatría. Hospital Infantil Universitario Miguel Servet. Zaragoza (España).
3 Servicio de Neurocirugía. Hospital Infantil Universitario Miguel Servet. Zaragoza (España).
4 Servicio de Oftalmología. Hospital Infantil Universitario Miguel Servet. Zaragoza (España).
PUNTOS CLAVE
- Concepto: aumento de la presión intracraneal sin alteraciones en la composición del líquido cefalorraquídeo (LCR) ni lesiones ocupantes de espacio.
- Etiopatogenia: desconocida a pesar de las numerosas hipótesis.
- Incidencia: estimada entre 1-2/100 000, con mayor incidencia en mujeres obesas de 15 a 44 años.
- Clínica: lo más frecuente es la cefalea, papiledema, diplopia y otras alteraciones visuales. En lactantes puede cursar únicamente con fontanela abombada e irritabilidad.
- Diagnóstico: clínico mediante los criterios de Dandy-Smith modificados y excluyendo lesiones ocupantes de espacio intracraneales.
- Tratamiento: hay tres escalones terapéuticos; el primero son las medidas de soporte, el segundo es farmacológico (acetazolamida de elección) y el tercero es quirúrgico invasivo.
- Pronóstico: bueno con evolución favorable y tendencia a la autorresolución sin precisar tratamiento en la mayoría de los casos
- Seguimiento: es necesario un estrecho seguimiento clínico y oftalmológico, siendo la periodicidad individualizada en función de la gravedad y el tratamiento precisado.
RESUMEN
La hipertensión intracraneal idiopática (HII) es una patología de etiología desconocida cuyo diagnóstico es clínico (criterios de Dandy-Smith modificados) y de exclusión, incluyendo signos y síntomas producidos por el aumento de la presión intracraneal sin alteraciones en la composición del líquido cefalorraquídeo, y excluyendo otras causas de hipertensión intracraneal mediante neuroimagen y otras evaluaciones. Las manifestaciones clínicas más frecuentes son cefalea, papiledema y diplopía u otras alteraciones visuales. El diagnóstico diferencial ha de realizarse con los procesos expansivos intracraneales y las hidrocefalias obstructivas.
El pronóstico es generalmente bueno con evolución favorable y tendencia a la autorresolución sin precisar tratamiento en la mayoría de los casos. Existen tres escalones terapéuticos: el primero consiste en medidas no farmacológicas para aliviar el aumento de presión intracraneal, el segundo asocia el uso de fármacos (acetazolamida de elección), y el tercero consiste en tratamiento quirúrgico invasivo.
INTRODUCCIÓN
La hipertensión intracraneal idiopática (HII) es una patología definida por criterios clínicos, que incluye signos y síntomas producidos por el aumento de la presión intracraneal (cefalea, papiledema y afectación visual) sin alteraciones en la composición del LCR, y por la exclusión de otras causas de hipertensión intracraneal (lesiones ocupantes de espacio, traumatismos craneoencefálicos, encefalitis y meningitis) mediante neuroimagen u otras evaluaciones. Por lo tanto, se trata de un diagnóstico evolutivo y de exclusión de patologías.
Existen otros términos utilizados para definir esta entidad, como es hipertensión intracraneal benigna; no obstante, esta denominación genera cierta controversia ya que pueden aparecer complicaciones oftalmológicas importantes, incluso ceguera. Clásicamente se denominaba como pseudotumor cerebri, término que algunos autores como Wall prefieren evitar1 y otros como Friedman2 continúan usando, porque engloban en ella la “verdadera” hipertensión intracraneal idiopática (sin causa conocida) y a la hipertensión intracraneal secundaria a una serie de entidades o fármacos que serán descritos posteriormente en el artículo.
Hay descrita una incidencia de HII de 1-2 por 100 000, y su incidencia es mayor en mujeres obesas de 15 a 44 años3. No existen datos de incidencia específicos para la población pediátrica, aunque también se describe sobre todo en niñas adolescentes con sobrepeso, pudiendo ser este el único factor desencadenante.
CLASIFICACIÓN DE LA HII PEDIÁTRICA SEGÚN GRUPOS ETARIOS
En la edad pediátrica se pueden distinguir dos grupos de edad, ya que presentan características clínicas y evolutivas diferentes:
- Niños con fontanela abierta, en los que se puede presentar como único hallazgo el abombamiento de fontanela anterior y con ecografía transfontanelar normal. Muchos casos consultan por abombamiento de fontanela descubierta por los padres de forma casual.
- Niños mayores (con fontanela ya cerrada), que pueden presentar un síndrome de hipertensión intracraneal más o menos completo, con papiledema y neuroimagen normal. El motivo de consulta más frecuente es la cefalea asociada a vómitos o alteraciones visuales, ya sea visión borrosa por edema de papila o diplopía por parálisis del VI par craneal; otros posibles síntomas asociados menos frecuentes son cervicalgia, dolor abdominal o ataxia.
En los casos de lactantes con fontanela abierta, la evolución suele ser favorable en pocos días, estando la mayor parte de los casos relacionados con infecciones víricas de vía respiratoria superior o con la supresión de tratamiento corticoideo por bronquitis; por lo que estrictamente no se trataría de una hipertensión intracraneal idiopática. En estos casos, tras confirmar que la ecografía transfontanelar es normal, se podría mantener una actitud expectante con un estrecho seguimiento clínico, sin que sea necesaria la realización de más exámenes complementarios, salvo que exista la sospecha de meningitis o encefalitis, en cuyo caso habría que realizar una punción lumbar de forma urgente4.
En este artículo, salvo comentarios aislados, en adelante haremos referencia solo a la hipertensión intracraneal idiopática de niños más mayores, con fontanela ya cerrada, en los que el cráneo ya no es distensible y presentan el cuadro típico.
ETIOPATOGENIA
La presión intracraneal (PIC) es el resultado de la variación relativa de los volúmenes de cada uno de los componentes contenidos en el cráneo (el 80% es cerebro, el 10% es LCR y el 10% es sangre). La PIC normal es de entre 5-15 mmHg, considerándose hipertensión intracraneal cifras mayores a 15 mmHg.
La patogenia de la HII es desconocida, existen muchas hipótesis para tratar de explicar su desarrollo: por alteración en la reabsorción y producción del LCR, edema cerebral, anomalías del control vasomotor y del flujo sanguíneo cerebral, así como obstrucción venosa, aunque hay autores que incluyen la estenosis de senos venosos como una entidad diferente a la HII.
Además de lesiones ocupantes de espacio, hidrocefalia, infección o trombosis de senos, que son las primeras entidades que descartar; en la literatura científica hay descritas múltiples asociaciones a diferentes entidades o fármacos con distintos grados de evidencia5, que resumimos a continuación:
- Factores claramente asociados: suspensión de tratamiento con corticoides, tratamiento con hormona de crecimiento (GH), hipervitaminosis A, obesidad o ganancia de peso reciente, insuficiencia suprarrenal, hipoparatiroidismo.
- Casos publicados con probable asociación: tratamiento con tetraciclinas, nitrofurantoína, indometacina, ketoprofeno, levotiroxina, análogos de la vitamina A. Lupus eritematoso sistémico. Uremia.
- Causas posibles, sin evidencia firme: anemia ferropénica, sarcoidosis, hipovitaminosis A. Tratamiento con sulfonamidas, ácido nalidíxico, litio.
- Características descritas en la literatura médica, pero que posteriormente se han demostrado como meras asociaciones casuales, sin evidencia de causalidad: terapia con corticoides, hipertiroidismo, menarquia, embarazo, anticonceptivos orales, irregularidades menstruales.
MANIFESTACIONES CLÍNICAS
A continuación se describen las principales manifestaciones clínicas:
- Cefalea: es el síntoma más común. Puede ser intermitente o persistente y ocurrir diariamente o con menor frecuencia. Puede llegar a despertar al paciente por la noche, empeorar con la tos, los cambios posturales y las maniobras de Valsalva. Puede asociar náuseas y menos frecuentemente vómitos. El dolor retrobulbar y el dolor con el movimiento ocular o con la compresión del globo ocular se refieren como los signos más específicos de la HII.
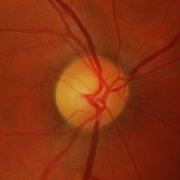
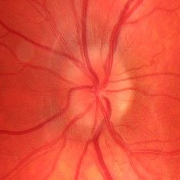
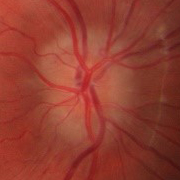
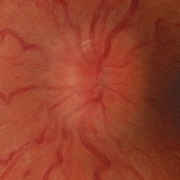
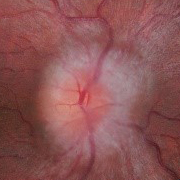
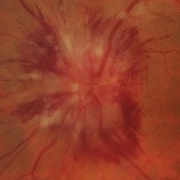
- Papiledema: es el signo más frecuente en la presentación y es indistinguible de los provocados por otras causas de hipertensión intracraneal. Normalmente es bilateral y simétrico. Un papiledema no tratado puede dar lugar a un déficit visual irreversible y atrofia óptica hasta en un 31% de los pacientes (datos en pacientes adultos, no hay disponibles actualmente datos sobre la población infantil, aunque se intuye que el pronóstico no es tan desfavorable).
- Alteraciones visuales: en pacientes que presentan papiledema puede aparecer pérdida transitoria de la visión, de segundos de duración, que puede ser unilateral o bilateral y de frecuencia variable. Estos síntomas visuales pueden ser precipitados por cambios de posición, maniobras de Valsalva, luz o movimientos oculares. La pérdida transitoria de visión no se asocia con el grado de elevación de la presión intracraneal ni con el pronóstico de la pérdida visual en el futuro. Otras alteraciones visuales que pueden aparecer son las fotopsias.
- Ruidos intracraneales: los pacientes refieren escuchar “viento” o “agua corriente”. Es un signo muy sugestivo de HII. Puede ser intermitente o persistente, y se cree que se trata de la transmisión de las pulsaciones vasculares a través del LCR ante una presión elevada en los senos venosos.
- Diplopía: se trata de una diplopía horizontal intermitente o continua, debida generalmente a la parálisis del sexto par craneal.
- Otros posibles síntomas asociados: cervicalgia, dolor abdominal, etc.
DIAGNÓSTICO
La HII se debe sospechar en aquellos niños con cefalea y papiledema en los que la neuroimagen es normal.
El diagnóstico es principalmente clínico, basándose en los criterios de Dandy-Smith modificados (Tabla 1).
Tabla 1. Criterios de Dandy-Smith modificados. Mostrar/ocultar
Una presión de apertura elevada en la punción lumbar es esencial para el diagnóstico de HII, pero puede haber dificultades en su medición e interpretación. Para ser lo más precisa posible, durante su realización el paciente debe estar en decúbito lateral y con las piernas extendidas, relajado y sin realizar maniobras de Valsalva, que elevarían la presión intrarraquídea. Puede ser necesaria su realización bajo sedación.
En niños pequeños (menores de 8 años) se han propuesto límites de medición superiores a los clásicamente descritos en adultos, particularmente en niños obesos o bajo sedación. Por tanto, las cifras que se suele manejar son las siguientes6:
- Niños <8 años: una presión del LCR >280 mm H2O se considera elevada. Entre 200-280 mm mm H2O debería interpretarse según la clínica asociada.
- Niños >8 años: una presión del LCR de 200 mm mm H2O se considera el límite superior de lo normal. Entre 200-250 mm H2O debe ser interpretada según la clínica asociada; >250 mm H2O se considera elevada.
DIAGNÓSTICO DIFERENCIAL
Los procesos expansivos intracraneales y las hidrocefalias obstructivas son la primera causa que plantearse en un niño que consulta por síntomas de hipertensión intracraneal y edema de papila. Una vez descartados, la sospecha es de HII, valorando otros diagnósticos de exclusión como los que se citan a continuación:
- Trombosis de los senos venosos cerebrales, que puede presentarse de forma aislada o como complicación de una otomastoiditis, frecuente en niños.
- Meningoencefalitis subagudas o crónicas.
- Encefalomielitis aguda diseminada.
- Carcinomatosis leptomeníngeas. Melanosis neurocutánea.
- Es relativamente frecuente que el papiledema pueda confundirse con otras entidades oftalmológicas que cursan con un pseudopapiledema, como pueden ser las drusas (acumulaciones de material extracelular en la retina). En ocasiones es preciso realizar ecografía ocular y angiografía con fluoresceína si existen dudas de que haya un verdadero edema de papila.
- En lactantes que asocien irritabilidad y vómitos siempre hay que tener en cuenta la posibilidad de que se trate de un lactante zarandeado.
ESTRATEGIA DIAGNÓSTICA
Anamnesis
Recoger los síntomas, características y tiempo de evolución de estos. Es importante interrogar por la toma de fármacos y complejos vitamínicos, que pueden ser los causantes del cuadro.
Exploración física
Recogida de constantes vitales, principalmente temperatura y presión arterial, y cálculo del índice de masa corporal. La hipertensión arterial puede provocar una neuropatía óptica, simulando un edema de papila acompañado de cefalea y otros síntomas similares.
Hay que realizar una exploración física y neurológica completa, que debe incluir el fondo de ojo. La evaluación oftalmológica es esencial en todos los pacientes en los que se sospecha HII tanto para confirmar el diagnóstico como para su control evolutivo.
Pruebas complementarias
Neuroimagen. Lo ideal es la realización de una resonancia magnética (RM) con gadolinio y una angio-RM. Si no es posible su realización en un intervalo de tiempo razonable, se debería realizar una tomografía computarizada (TC) craneal para descartar lesiones ocupantes de espacio. La TC no exime de la realización posterior de una RM cerebral que pueda identificar otras alteraciones que orienten o establezcan el diagnóstico y que puedan pasar desapercibidas en la TC, como la trombosis venosa cerebral, la encefalomielitis aguda diseminada o las carcinomatosis leptomeníngeas, entre otras.
Punción lumbar. Además de para medir la presión de apertura del LCR y constatar la hipertensión intracraneal, la punción lumbar se debe realizar para descartar meningoencefalitis subagudas y realizar estudios serológicos y microbiológicos. En LCR se solicita recuento celular, bioquímica, cultivo de virus y bacterias y serologías (virus neurotropos, Borrelia, Brucella, Mycoplasma, lúes). Sería conveniente hacerla tras la realización de la RM, ya que podría evitarse si la RM establece un diagnóstico que hace innecesaria la punción lumbar, como una trombosis venosa o alguna lesión ocupante de espacio.
La punción lumbar es además maniobra terapéutica por disminuir la presión intracraneal; frecuentemente la clínica mejora tras su realización.
Es recomendable reservar una muestra de LCR (unas 20 gotas) para valorar realizar otros estudios ante una mala evolución, como puede ser estudios de anatomía patológica (carcinomatosis leptomeningeas).
Analítica sanguínea para descartar alteraciones metabólicas o desórdenes sistémicos subyacentes. Es conveniente solicitar hemograma, bioquímica y proteína C reactiva, metabolismo del hierro (anemia ferropénica), calcio iónico (las alteraciones iónicas también son causa de HII). Coagulación (conveniente realizarla previa a la punción lumbar) y D-dímero (en el despistaje de trombosis, que estaría elevado). Vitamina A y D. Hormonas tiroideas, hormona adrenocorticotropa (ACTH) y cortisol (valorar interconsulta a endocrino si sospecha de otro trastorno endocrinológico asociado: pubertad precoz, hormona paratiroidea…). Se puede plantear la realización de un estudio de autoinmunidad, aunque es poco probable que una enfermedad autoinmune, como pudiera ser un lupus eritematoso sistémico, debutara como una HII sin ninguna otra sintomatología acompañante que pudiera orientar su diagnóstico.
Los estudios serológicos en sangre para virus neurotrópos, Mycoplasma, Borrellia y Brucella complementarán las serologías realizadas en LCR.
Valoración por Oftalmología: para confirmar el papiledema y completar estudio oftalmológico con campo visual (CV) y agudeza visual (AV). Los controles periódicos oftalmológicos son fundamentales para monitorizar la evolución de la enfermedad. La repercusión oftalmológica es el principal problema que se plantea a largo plazo.
La pérdida de agudeza visual no suele ocurrir en un papiledema agudo salvo que exista edema en la mácula. La agudeza visual y la percepción de los colores generalmente suele estar preservada a menos que nos encontremos en una fase crónica o atrófica. La valoración del campo visual es más sensible para detectar el daño en el nervio óptico que va a producir pérdida visual, ya que se afecta en estadios precoces de la enfermedad.
TRATAMIENTO
El tratamiento tiene dos objetivos fundamentales: conseguir la remisión de los síntomas y preservar la función visual del paciente evitando posibles secuelas, disminuyendo la presión intracraneal.
La principal morbilidad asociada es la pérdida de visión; aunque las cefaleas persistentes también pueden llegar a influir en la calidad de vida del paciente.
No hay ensayos clínicos que documenten el efecto de los tratamientos en la HII y las recomendaciones se basan en estudios observacionales de pequeñas muestras de pacientes. No existen guías que especifiquen si se debe iniciar tratamiento farmacológico de entrada ni si existe beneficio por ello. Tras revisar la literatura científica existente hasta el momento, resumimos y exponemos las siguientes recomendaciones7-10:
Si se localiza la causa que la ha provocado: tratamiento específico o suprimir el fármaco o factor que la provoque. No todos los pacientes requieren tratamiento. Una vez establecido el diagnóstico, en los pacientes asintomáticos con visión normal y mínimo papiledema puede mantenerse una actitud expectante y resolverse el cuadro espontáneamente (aunque puede tardar meses). Independientemente, estos casos también deben llevar un estrecho seguimiento para vigilar si desarrollan síntomas o empeoramiento visual que precise iniciar tratamiento farmacológico.
Se recomienda iniciar tratamiento farmacológico si existe alguna de estas circunstancias:
- Alteración del campo visual (aparte de leve aumento de la macha ciega).
- Disminución de la agudeza visual.
- Papiledema moderado-severo (grado 3-5 de Frisén) (Tabla 2).
- Cefalea importante de mal control con analgésicos.
Tabla 2. Clasificación del papiledema según la escala de Frisén. Mostrar/ocultar
Existen distintos escalones terapéuticos según la gravedad: actitud expectante y medidas higiénico dietéticas generales, tratamiento farmacológico o tratamiento quirúrgico.
Primer escalón. Medidas generales
- Restricción hidrosalina: evitar el exceso de aporte de sal en las comidas.
- Pérdida de peso en los casos en que se presente sobrepeso u obesidad asociados, como medida a largo plazo.
Segundo escalón. Tratamiento farmacológico
Acetazolamida. Es el fármaco de primera línea, un inhibidor de la anhidrasa carbónica, que actúa inhibiendo la producción de LCR de los plexos coroideos. Para que ejerza este efecto, son necesarias dosis altas, que pueden no ser bien toleradas, principalmente por síntomas gastrointestinales. Se recomienda la monitorización de electrolitos y bicarbonato ya que puede producir acidosis metabólica, hipopotasemia e hiponatremia. No obstante, los niños suelen tolerar bien la acidosis. Hay autores que no realizan controles a los niños en tratamiento con acetazolamida, mientras que otros autores que han monitorizado electrolitos y bicarbonato de forma semanal constatan que no suelen requerir bicarbonato sódico.
Su posología es la siguiente:
- Niños: 15-25 mg/kg/día, repartida en 3-4 dosis. Si no hay mejoría, aumentar progresivamente la dosis durante dos meses, hasta un máximo de 2 g/día o 100 mg/kg en niños y 4 g/día en adolescentes. Se incrementan 25 mg/kg/día hasta que haya respuesta clínica o hasta alcanzar la dosis tolerada.
- Adolescentes: 1 g/día dividido en 3-4 dosis. Se incrementa a un ritmo de 250 mg/día, según eficacia y tolerancia, hasta un máximo de 4 g/día.
Furosemida. Como diurético de asa, inhibe la reabsorción de sodio, provocando la depleción de líquido extracelular. Se suele utilizar en lugar de acetazolamida en los pacientes en los que esta no es bien tolerada, o asociado a ella para sumar los efectos de los distintos mecanismos de acción. Por este motivo existe mayor posibilidad de hipopotasemia e hiponatremia. Las dosis habituales utilizadas son:
- Niños: 1 mg/kg/día, repartida en dos tomas.
- Adultos: 20-40 mg/día, repartida en dos tomas.
Topiramato. Se ha considerado su uso en adultos ya que, además de inhibir la anhidrasa carbónica, tiene efecto terapéutico para la cefalea crónica y ayuda a la pérdida de peso. Sin embargo, todavía faltan estudios para considerarlo un medicamento de primera línea para el tratamiento de la hipertensión intracraneal.
Las dosis utilizadas son entre 1,5-3 mg/kg al día, divididas en dos dosis (no más de 200 mg/día). Ascenso lento de 25 mg por semana.
Corticoides. Los corticoides no están indicados de rutina ni durante largos periodos de tiempo. Puede ser útil como tratamiento adyuvante en pacientes con rápido deterioro de la función visual mientras se plantea la posibilidad de un proceso quirúrgico (ver posteriormente hipertensión intracraneal idiopática “maligna o fulminante”). La retirada de los corticoides puede llevar a un aumento rebote de la presión intracraneal. Además, sus efectos secundarios (ganancia de peso, retención de líquidos, hiperglucemia), pueden ser problemáticos en estos pacientes.
Prednisona 2 mg/kg/día durante 2 semanas con descenso progresivo durante otras 2 semanas. En casos graves se puede poner previamente un bolo de metilprednisolona (15 mg/kg) antes de empezar con el corticoide oral.
La HII “maligna o fulminante” se utiliza para designar a pacientes en los que se desarrolla un rápido deterioro de la función visual, en los que existe una significativa pérdida del campo visual y un importante papiledema desde el comienzo y que a menudo también tienen disminución de su agudeza visual. La pérdida visual puede ocurrir en días o semanas. Los criterios diagnósticos son los siguientes11:
- Debut agudo de síntomas y signos de hipertensión intracraneal.
- Menos de 4 semanas desde el inicio de los síntomas y la afectación visual.
- Empeoramiento rápido del déficit visual en días.
- RM o angio-RM que descarte trombosis de senos venosos.
El tratamiento debe ser rápido y agresivo: acetazolamida y corticoides intravenosos, e incluso planteamiento quirúrgico precoz. La trombosis de senos venosos es un importante diagnóstico de exclusión en estos casos.
Otros tratamientos farmacológicos. Los pacientes pueden continuar con cefaleas a pesar de la mejoría del papiledema y la función visual. En estos casos se usan a menudo fármacos utilizados en la profilaxis de migraña para intentar controlar el dolor e intentar evitar un uso excesivo de analgésicos, que también pueden provocar dolor de cabeza. Hay que ser cuidadosos en su elección ya que en muchos casos pueden provocar aumento de peso. El topiramato podría ser una opción que tener en cuenta por su efecto inhibidor de anhidrasa carbónica y favorecer la pérdida de peso.
En la Figura 1 se propone un esquema general de tratamiento farmacológico para los casos en los que esté indicado.
Figura 1. Propuesta de algoritmo de tratamiento. Mostrar/ocultar
Tercer escalón. Tratamiento invasivo
Los procedimientos quirúrgicos terapéuticos se reservan para niños con deterioro progresivo de la función visual a pesar del correcto tratamiento médico y para tratamiento de formas fulminantes. Raramente, la cirugía está justificada en los casos de cefaleas refractarias a tratamiento médico relacionadas con elevaciones crónicas de la presión intracraneal12.
Las punciones lumbares repetidas generalmente no están recomendadas, por ser un procedimiento doloroso para el paciente y por sus posibles complicaciones. Los principales procedimientos disponibles son la derivación lumboperitoneal o ventriculoperitoneal y la fenestración de la vaina del nervio óptico.
La fenestración de la vaina del nervio óptico se reserva para pacientes con deterioro visual progresivo, con ausencia de o mínima cefalea, ya que esta técnica no disminuye la presión intracraneal. Se cree que el mecanismo de acción es la creación de una fístula que provoca la descompresión local del espacio subaracnoideo.
Hasta la fecha, no existen estudios aleatorizados en niños que comparen la eficacia de estas intervenciones quirúrgicas. En la mayoría de las series se recoge la utilización de la derivación lumboperitoneal, que es menos invasiva que la ventriculoperitoneal y ha demostrado mejorar los síntomas y la función visual. No obstante, estas técnicas no están exentas de riesgo y pueden presentar complicaciones como obstrucción del shunt, hemorragia, infecciones o cefaleas por baja presión, entre otras. En la técnica de fenestración también pueden aparecer complicaciones como dilatación pupilar persistente por daño sobre el ganglio ciliar, oftalmoplejia y diplopía, oclusión de la arteria retiniana o neuropatía óptica traumática.
Una de las hipótesis causales de la HII es la estenosis de senos venosos cerebrales, por ello, desde hace una década se han llevado a cabo estudios con implantes de stents en pacientes con esta patología, pero la literatura científica existente es escasa y de casos aislados, por lo que serían necesarios más estudios para poder establecer la utilidad de este procedimiento13.
SEGUIMIENTO
Es necesario un estrecho seguimiento clínico y oftalmológico. Puede ser razonable la evaluación inicial cada 2 semanas e ir espaciando las visitas posteriormente si la evolución es favorable. No obstante, las visitas de seguimiento deberán individualizarse en función de la gravedad y respuesta al tratamiento.
La retirada progresiva del tratamiento farmacológico en los casos en los que se ha instaurado se realiza cuando el estado visual del paciente y la apariencia del nervio óptico se han estabilizado, o cuando la enfermedad ha estado en remisión durante al menos 6 meses. El descenso progresivo de la acetazolamida se aconseja durante un mínimo de 2 meses.
Los pacientes deben continuar siendo monitorizados periódicamente, ya que no es raro encontrar recurrencias en esta fase. La recurrencia de los síntomas puede ocurrir en el 8-38% de los pacientes que se han recuperado de un episodio o tras un prolongado periodo de estabilidad, incluso años después del primer episodio. La ganancia de peso se ha asociado a la recurrencia en algunos pacientes14.
BIBLIOGRAFÍA
- Wall M, Corbett JJ. Revised diagnostic criteria for the pseudotumor cerebri syndrome in adults and children. Neurology. 2014; 83:198-9.
- Friedman DI, Liu GT, Digre KB. Revised diagnostic criteria for the pseudotumor cerebri syndrome in adults and children. Neurology 2013; 81:1159-65.
- Radhakrishnan K, Ahlskog JE, Cross SA, Kurland LT, O’Fallon WM. Idiopathic intracranial hypertension (pseudotumor cerebri). Descriptive epidemiology in Rochester, Minn, 1976 to 1990. Arch Neurol. 1993; 50: 78-80.
- Monge Galindo L, Pérez Delgado R, López-Pisón J, Olloqui-Escalona A, García Iñiguez JP, Ruiz del Olmo Izuzquiza I, et al. Hipertensión intracraneal benigna: experiencia en 18 años. An Pediatr (Barc). 2009;71:400-6.
- Wall M. Idiopathic intracranial hypertension. Neurol Clin. 2010;28:593-617.
- Avery RA, Licht DJ, Shah SS, Huh JW, Seiden JA, Boswinkel J, et al. CSF opening pressure in children with optic nerve head edema. Neurology. 2011;76:1658-61.
- Friedman DI, Jacobson DM. Idiopathic intracranial hypertension. J Neuro-Ophthalmol. 2004;24:138-45.
- Honorat R, Marchandot J, Tison C, Cances C, Chaix Y. Traitement et prognostic de l’hypertension intracrânienne idiopathique de l’enfant. Étude rétrospective (1995-2009) et revue de la littérature. Archives de Pédiatrie. 2011;18:1139-47.
- Ko MW, Liu GT. Pediatric idiopathic intracraneal hipertensión (pseudotumor cerebri). Horm Res Paediatr. 2010;74:381-9.
- Lee AG, Wall M. Idiopthic intracranial hypertension (pseudotumor cerebri): prognosis and treatment. En: UpToDate [en línea] [consultado el 06/03/2018]. Disponible en: https://www.uptodate.com/contents/idiopathic-intracranial-hypertension-pseudotumor-cerebri-prognosis-and-treatment
- Thambisetty M, Lavin PJ, Newman NJ, Biousse V. Fulminant idiopathic intracranial hypertension. Neurology. 2007;68:229-32.
- Biousse V, Bruce BB, Newman NJ. Update on the pathophysiology and management of idiopathic intracranial hypertension. J Neurol Neurosurg Psychiatry. 2012;83:488-94.
- Bidot S, Bruce BB. Update on the diagnosis and treatment of idiopathic intracranial hypertension. Semin Neurol. 2015;35:527-38.
- Ko MW, Chang SC, Ridha MA, Ney JJ, Ali TF, Friedman DI, et al. Weight gain and recurrente in idiopathic intracranial hypertension: a case-control study. Neurology. 2011;76:1564-7.
LECTURAS RECOMENDADAS
-
Avery RA, Licht DJ, Shah SS, Huh JW, Seiden JA, Boswinkel J, et al. CSF opening pressure in children with optic nerve head edema. Neurology 2011;76:1658-61.
Este artículo recoge los valores considerados normales y patológicos de la presión de salida del LCR, lo cual supone un valor de gran importancia en el diagnóstico de HII, ya que puede ser el único hallazgo patológico en las pruebas complementarias realizadas.
-
Honorat R, Marchandot J, Tison C, Cances C, Chaix Y. Traitement et prognostic de l’hypertension intracrânienne idiopathique de l’enfant. Étude rétrospective (1995-2009) et revue de la littérature. Archives de Pédiatrie. 2011;18:1139-47.
En el citado artículo se exponen los resultados de un amplio estudio retrospectivo, así como una revisión de la literatura médica hasta el momento, corroborando la escasa proporción de pacientes que requieren tratamiento frente a los de resolución espontánea.